
题目列表(包括答案和解析)
31.(2分)下列有关实验的叙述,正确的是(填序号) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉溶液中混有的NaCl杂质
(C)无法用分液漏斗将酒精和水的混合液体分离
(D)为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(E)浓硫酸不小心沾到皮肤上,立刻用NaOH溶液洗涤
(F)除去FeCl3酸性溶液中少量的FeCl2,可加稍过量的双氧水
30.甲醇属于再生能源,可代替汽油作为汽车燃料。下列能正确表示甲醇燃烧热的热化学方程式为 ( )
A.CH3OH(1)+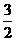 O2(g)=CO2(g)+2H2O(1) △H=+763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=+763.3kJ·mol-1
B.CH3OH(1)+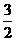 O2(g)=CO2(g)+2H2O(1) △H=-763.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=-763.3kJ·mol-1
C.CH3OH(1)+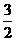 O2(g)=CO2(g)+2H2O(1) △H=-675.3kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H=-675.3kJ·mol-1
D.2CH3OH(1)+3 O2(g)=2CO2(g)+4H2O(1) △H=-1526.6kJ·mol-1
第Ⅱ卷(非选择题 共40分)
29.用含少量铁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是 ( )
①加盐酸溶解; ②加烧碱溶液溶解;③过滤;
④通入过量CO2生成Al(OH)3沉淀;
⑤加入盐酸生成Al(OH)3沉淀; ⑥加入过量烧碱溶液。
A.①⑥⑤③ B.②③⑤③ C.②③④③ D.①③⑤③
28.向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据 ( )
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要在补充数据
27.镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的阴离子有 ( )
A.AlO2- B.Cu2+ C.Al3+ D.OH-
26.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是 ( )
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1molNa2FeO4共转移3mol电子
C.干法中每生成1molNa2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
25.下列关于浓硫酸和浓硝酸的说法中正确的是 ( )
A.常温下都可用铝制容器贮存 B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快反应 D.露置城空气中,容器内酸液的浓度都降低
24.m g H2和n g He(均为气体)的下列说法中,正确的是 ( )
A.同温同压下,H2与He的体积比为m:2n
B.同温同压下,若m=n,则H2与He的分子数之比为1:2
C.同温同压下,同体积时,H2与He的质量比m/n>1
D.同温同压下,H2与He的密度比为1:2
23.对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,原溶液一定有NH4
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,原溶液一定有Ba2+
22.下列事实能判断金属元素甲的金属性一定比乙强的有 ( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多
A.全部可以 B.仅②可以 C.仅②⑤不可以 D.①③④可以
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com