
题目列表(包括答案和解析)
34.(7分)(1)2Al+2OH-‑+2H2O==AlO2-+3H2↑(2分)
AlO2+4H+=Al3++2H2O(2分)
|
(3)2Cu+O2 2CuO;CuO+H2SO4=CuSO4+H2O(2分);
33.(8分)(1)FeCl2 KCl
(2)Fe+2H+=Fe2++H2↑
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe+2FeCl3=3FeCl2(方程式每个2分)
32.(10分)(1)A;碳 C:钠 D:硫
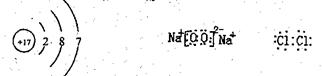 (2)
(2)
(3)2Na2O+2CO2=2Na2CO3+O2 (1分)
(4)Cl2+H2O=Cl-+H++HClO (用可逆号也可以 1分)
(5)C6H6(1)+15/2O2(g)=6CO2(g)+3H2O(1) △H=-3260.4kJ/mol
31.(2分)BCF(对一个给1分,对2个给2分,只要错一个即为0分)
21.A 22.D 23.C 24.D 25.AD 26.A 27.AD 28.C 29.C 30.B
1-5BCBAB 6-10BDCBB 11-15DDBCD 16-20DADCC
36.(5分)将6g的铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL、0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算:
(1)反应后生成铜的质量;
(2)原溶液中Fe2(SO4)3的物质的量浓度。
|
34.(7分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(七水合硫酸亚铁)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
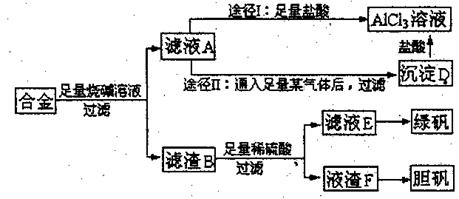
试回答下列问题:
(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式 ;
写出途径I中相关反应的离子方程式 。
(2)由滤液A制AlCl3溶液有途径I和途径II两种,你认为哪种途径比较合理,说明理由 。
(3)按环保要求,写出用滤渣F制备硫酸铜溶液的各步反应的化学方程式
 35.(8分)回答下列问题:
35.(8分)回答下列问题:
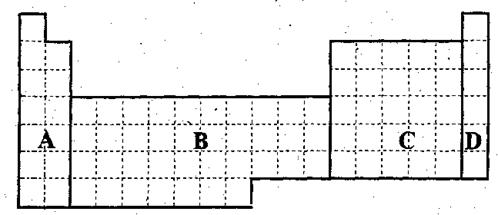
(1)在上面元素周期表中全部是金属元素的区域为 (填写字母),6号到12号元素的单质可以导电的元素有 种。
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素的元素名称是 。
(3)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族。
(4)现有甲、乙、丙三种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等,丙元素为第三周期元素且最高正价与最低负价的绝对值之差为6。用元素符号将甲、乙、丙三元素填写在上面元素周期表中对应的位置。并用离子符号排出三种元素简单离子的半径由大到小的顺序 。
33.(8分)已知有以下物质相互转化

试回答:
(1)写出B的化学式 ;D的化学式 。
(2)写出上述转化过程中属于置换反应的化学反应的离子方程式 。
(3)写出上述转化过程中属于化合反应的所有化学反应的化学方程式
(有几个写几个);
32.(10分)A、B、C、D、E五种元素,已知:
(a)A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。
(b)常温下B2是气体,它对氢气的相对密度是16。
(c)C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
(d)D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激味的气体DB2。D在DB2中的含量为50%。
根据以上情况回答:
(1)A是 、C是 、D是 (写元素名称);
(2)E的原子结构示意图 ;F的电子式 ;E2的电子式 。
(3)F和AB2反应的化学方程式
(4)E2与水反应的离子方程式
(5)室温下,将2g苯和过量的B2混合,完全燃烧,放出83.6kJ的热量,写出表示苯的燃烧热的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com