
题目列表(包括答案和解析)
24.(8分)某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下
列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH
溶液,均至反应后溶液体积1 L。测得部分实验数据如下表:
|
pH |
9 |
10 |
11 |
|
c(Mg2+)/ mol·L-1 |
10-1 |
10-3 |
10-5 |
|
c(AlO2―)/mol·L-1 |
10-2 |
10-1 |
1 |
试回答:
(1)若向混合溶液中加入NaOH溶液至pH=9,请用所给的实验数据判断,有否Mg(OH)2
沉淀出现________(填“能”或“否”),由此你得到的初步结论是__________________。
(2)若向混合溶液中加入NaOH溶液至pH=10,请写出反应各阶段所发生反应的离子方程式__________,____________,_________________,________________,那么,所加入的NaOH溶液中溶质的的物质的量为_____________。
23.(12分)
(1)小苏打、胃舒平、达喜都是常用的中和胃酸(主要成分为盐酸)的药物。
①市售小苏打片每片含0.42 gNaHCO3,根据医嘱,某病人一次要服用2片小苏打片,
则可中和盐酸 mol。
②若改用胃舒平,要达到同样药效,需胃舒平 片。[胃舒平每片含0.260gAl(OH)3]
③达喜的化学成分是铝和镁的碱式盐,其化学式为:Al2Mg6(OH) 16CO3·4H2O。请写出达喜和胃酸反应的化学方程式
(2)ag铁粉放入含bmolHNO3的稀硝酸中,加热充分反应后,再加入稀硫酸,铁粉恰好完 全溶解,经测定溶液中只含Fe3+和SO42-。
①写出所发生反应的离子方程式 。
②反应中被还原的元素是名称是 。
22.判断下列说法正确的是 ( )
A.强电解质溶液的导电性一定比弱电解质溶液的导电性强
B.离子化合物都是强电解质
C.其水溶液能导电的物质都是电解质
D.强电解质都是离子化合物,弱电解质都是共价化合物
第Ⅱ卷(共56分)
21.将少量金属钠投入到氯化铁溶液中,产物是 ( )
A.NaOH、H2 B.Fe、NaCl
C.Fe(OH)3、NaCl、H2 D.H2、NaCl、NaOH
20.用1 L1.0mol·L-1NaOH溶液吸收0.8molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是 ( )
A.1:3 B.2:1 C.2:3 D.3:2
18.汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进
行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确是 ( )
A.易溶于酸或碱 B.用盐的形式表示:BaSiO3·CuSiO3
C.用氧化物形式表示:BaO·CuO·2SiO2 D.性质稳定,不易褪色
|
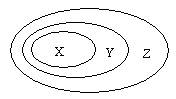 19.用右图表示的一些物质或概念间的从属或包含关系中不正确的 ( )
19.用右图表示的一些物质或概念间的从属或包含关系中不正确的 ( )
|
|
X |
Y |
Z |
|
例 |
氧化物 |
化合物 |
纯净物 |
|
A |
氯化钠 |
盐 |
无机物 |
|
B |
强电解质 |
电解质 |
化合物 |
|
C |
浊液 |
分散系 |
混合物 |
|
D |
置换反应 |
氧化还原反应 |
离子反应 |
17.下列说法不正确的是 ( )
A.Na2CO3 比NaHCO3 易溶于水
B.Na2CO3 比NaHCO3 难分解
C.溶质的物质的量浓度相同时,NaHCO3溶液比Na2CO3 溶液的碱性强
D.与足量盐酸反应得到相同质量的CO2,所用NaHCO3比Na2CO3 的质量要少
16.检验下列物质X是否已部分被氧化变质, 所选用的试剂Y正确的是 ( )
|
选项 |
A |
B |
C |
D |
|
X |
Na2SO3溶液 |
FeCl2溶液 |
NaBr溶液 |
H2S溶液 |
|
Y |
BaCl2溶液 |
KSCN溶液 |
淀粉试液 |
NaOH溶液 |
15. 赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O + Cu2S 6Cu + SO2 对于该反应,下列说法中错误的是 ( )
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O + Cu2S 6Cu + SO2 对于该反应,下列说法中错误的是 ( )
A.反应中铜元素既被氧化又被还原 B.还原产物与氧化产物的物质的量之比为6:1
C.Cu2O在反应中只作氧化剂 D.反应中被氧化的元素是S
14.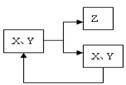 工业生产中物质的循环利用有多种模式,符合下图所示,说
工业生产中物质的循环利用有多种模式,符合下图所示,说
法正确的是是 ( )
A.可表示工业冶炼镁Cl2的循环
B.可表示电解饱和食盐水中NaCl的循环
C.可表示氨氧化法制硝酸中NO的循环
D.可表示合成氨中的N2、H2的循环
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com