
题目列表(包括答案和解析)
31. (6分)二氧化硫是一种酸性氧化物,能与氢氧化钠溶液反应。反应产物与反应物的量有关,当二氧化硫过量时,生成亚硫酸氢钠;当氢氧化钠过量时,生成亚硫酸钠。
(1)请写出上述反应的化学方程式 、
。
(2)某硫酸厂每天排放1.12×104 m3(标准状况)尾气,其中含0.2%(体积分数)的SO2,现欲用2.0 mol·L-1氢氧化钠溶液进行处理,每天至少需氢氧化钠溶液 L。
莆田一中2008-2009学年度上学期第一学段考试答卷
高三 化学
第Ⅱ卷(共50分)
30. (8分)已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的 化合物;B和X的摩尔质量相同,E的式量比D的式量大16,在一定条件下,
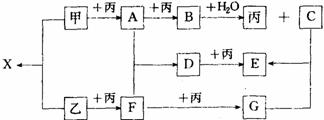 各物质相互转化关系如下图所示:
各物质相互转化关系如下图所示:
① 写出X和G的化学式
X ,G 。
② 写出有关变化的化学方程式
B+H2O: ;
D+丙: 。
29. (13分)自然界中存在的天然纯碱主要来自于碱湖和固体碱矿。工业上以氯化钠为原料生产纯碱。
我国化工专家侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨水的氯化钠饱和溶液中,使碳酸氢钠从溶液中析出,过滤得到碳酸氢钠晶体。(已知氯化钠、碳酸氢钠、碳酸氢铵在20℃下的溶解度分别为:36g、9.6g、21.7g)侯氏制碱法的流程如下图:

(1)请写出制取碳酸氢钠的化学方程式: ,碳酸氢钠能从溶液中析出的原因是: 。
(2)侯氏制碱法的原理是将二氧化碳通入氨水的氯化钠饱和溶液中,能否将其改为“将氨水通入到二氧化碳的氯化钠饱和溶液”呢? (填“能”、“不能”)你选择的理由是: 。
(3)将析出的碳酸氢钠晶体煅烧,分解得到碳酸钠。写出该反应的化学方程式: 。
(4)在滤出碳酸氢钠后的母液中加入石灰水,生成的氨可以重新利用,写出发生反应的化学方程式: 。反应的另一产物氯化钙被弃掉,母液中食盐的利用率只有70%。侯德榜先生经过多年的摸索和实践,在过滤出碳酸氢钠后的母液中,不加石灰水,而是在降温到t℃后加食盐,利用低温下氯化铵比氯化钠溶解度小的特点,加入的食盐在连续循环操作中不断被利用,使食盐的利用率提高到96%。同时,析出的氯化铵又可作为化学肥料。请根据下表所给有关溶解度的数据,推测温度t应在 左右。
|
|
0℃ |
10℃ |
20℃ |
30℃ |
|
NaCl |
35.7
g |
35.8
g |
36.0
g |
36.3
g |
|
NH4Cl |
29.4
g |
33.3
g |
37.2
g |
41.4
g |
28. (9分)1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
Fe3+、H+、NH4+、Al3+、K+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、ClO-、AlO2- |
(1)
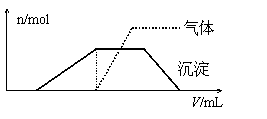 往该溶液中逐滴加入NaOH溶液并适当
往该溶液中逐滴加入NaOH溶液并适当
加热,产生沉淀和气体的物质的量(n)与加
入NaOH溶液的体积(V)关系如图所示。
不能确定是否含有的阳离子有 ,
要确定其存在可补充做实验的是 ;肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
|
n (Cl-) |
1.25 mol |
1.5 mol |
2 mol |
|
n(Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
|
n(I-) |
a mol |
0 mol |
0 mol |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为
。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
27. (7分)某同学在一只烧杯里装有a g纯铁粉,加入200mL 6mol/L硝酸恰好完全溶解铁粉(假设还原产物只有NO)。请完成对产物中铁元素价态的探究:
(1)提出合理假设:
假设1:产物只有+2价铁;
假设2: ;
假设3: 。
(2)设计实验:分别取反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。推测实验现象与结论:①若现象为: ,则假设1正确;
②若现象为: ,则假设2正确;
③若现象为: ,则假设3正确。
(3)a值范围为 。
26. (7分)知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应的氧化剂是 。若有0.75mo1的还原剂被氧化,则被还原的氧化剂是 mol。
(2)NaNO2有像食盐一样的咸味,误食会使人中毒,可以用试剂和生活中常见的物质进行实验鉴别NaNO2和 NaCl,现有物质①自来水 ②碘化钾一淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒 ,在进行实验时,必须选用的物质有 (填编号)。
(3)某厂废液中含2%的NaNO2,直接排放会造成污染,下列试剂中: ①NaCl ②NH4C1 ③浓H2SO4 能使NaNO2转化为不引起二次污染物质N2,且不产生有污染气体的是 (填编号),反应的化学方程式为 。
25.
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
第Ⅱ卷(共50分)
24. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为( )
A.1 :7 B.7 :1 C.7 :8 D.8 :7
23. 蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是 ( )
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
22.
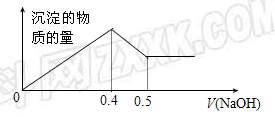 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中
Cl-与SO42-的物质的量之比为( )
A.1 :3 B.2 :3
C.6 :1 D.3 :1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com