
题目列表(包括答案和解析)
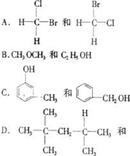
5.在下列各组化合物的结构表达式中,不能互称为同分异构体的是 ( )
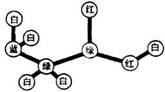
4.某实验小组对甲、乙、丙、丁四种固体样品的性质进行测试,结果如下:
 物质 物质性质 |
甲 |
乙 |
丙 |
丁 |
|
熔点 |
高 |
低 |
高 |
低 |
|
水溶性 |
溶 |
不溶 |
不溶 |
溶 |
|
高温加热 |
稳定 |
分 |
稳定 |
稳定 |
|
导电性 |
导电 |
不导电 |
不导电 |
导电 |
则这4种固体物质中最有可能属于有机物的是 ( )
A.甲 B.乙 C.丙 D.丁
3.下列各物质中,互为同系物的是

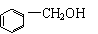
A. 和 B.HCOOCH3和CH3COOH
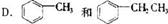 C.油酸和软脂酸
C.油酸和软脂酸
l.下列物质中,没有固定沸点的是
A.聚乙烯 B.氯仿 C.甲苯 D.异丁烷
2.某期刊封面上有如下一个分子的球棍模型图。图中“棍”代表单键或双键或叁键。不同颜色的球代表不同元素的原子,该模型图可代表一种
A.卤代羧酸
B.酯 C.氨基酸 D.醇钠
20.(9分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ __。
A.9 B.13 C.11-13之间 D.9-11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
(4) 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)
与c(Cl-)的关系c(NH4+) c(Cl-)。
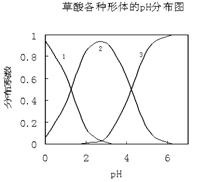 21.(10分)草酸(H2C2O4)是一种易溶于水的二元弱酸,在水中它的存在形态可能有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如下图所示:
21.(10分)草酸(H2C2O4)是一种易溶于水的二元弱酸,在水中它的存在形态可能有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如下图所示:
(1)上图中曲线1表示_______的变化;曲线2表示________的变化。
(2)若已知H2C2O4的电离平衡常数为Ka1=5.6×10-2、Ka2=5.1×10-5,当[H2C2O4]=[ HC2O4-]时,溶液的[H+]=_______;当[H2C2O4]=[C2O42-]时,溶液的[H+]=_______。
(3)K2C2O4溶液中,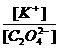 2
(填“>”、“=”、“<”),原因是
2
(填“>”、“=”、“<”),原因是
。(用离子方程式表示)
(4)(KHC2O4溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
A.[K+]+[H+]=[HC2O4-]+[OH-]+[C2O42-]
B.[HC2O4ˉ]+[C2O42-]=0.1 mol·L-1
C.[C2O42ˉ]>[H2C2O4]
D.[K+]=[H2C2O4]+[HC2O4―]+[C2O42-]
(5)测定人体血液中钙离子的含量时,可取2 mL血液用蒸馏水稀释后,先向其中加人足量H2C2O4晶体(没有沉淀产生),再向溶液中加入尿素,并逐渐加热,当加热到90℃左右时,可以均匀而缓慢地析出CaC2O4沉淀。将沉淀用稀硫酸处理得草酸(H2C2O4)后,再用KMnO4的酸性溶液滴定(氧化产物为 CO2,还原产物为 Mn2+),终点时用去12.0mL 0.002mol·L-1的高锰酸钾溶液。(已知CaC2O4的溶度积为2.0×10-9)
试回答下列问题:
①解释为何在溶液中加入草酸不生成沉淀,而加入尿素后有沉淀生成?
_______________________________________________________________。
②人体血液中钙离子的含量为______________g/mL。
19.(12分)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
18.(8分).工业上采用湿法炼锌过程中, 以ZnSO4为主要成分的浸出液中,有Fe3+、Fe2+、Sb3+、Cu2+、Cd2+、Cl-等杂质,这些杂质对下一道锌的电解工序有妨碍,必须事先除去。现有下列试剂:
① KMnO4;②NaOH;③ZnO;④H2O2;⑤Zn;⑥Fe;⑦AgNO3;⑧Ag2SO4;⑨H2SO4
根据要求将合适的试剂的序号填入下面的空格:
(1)用 将Fe2+离子氧化成Fe3+离子,相应的离子方程式为 。
(2)用 调节浸出液的pH = 5.2时, 、 等形成氢氧化物沉淀。
(3)用 除去Cu2+和Cd2+离子。
(4)用 除去Cl-离子。
17.(6分)化学分析实验时,鉴定SO32-离子的方法之一是利用SO32-的还原性。将SO32-在稀酸中加入适量的碘-淀粉蓝色溶液,会使蓝色褪去,反应为:SO32-+I2 + H2O=SO42-+ 2H+ +2I-
(1)若待测液中有S2O32-,会不会对实验有干扰,其原因是_______________________。
(2)若待测液中有S2-和SO32-时,除去S2-的常用方法是在检验SO32-之前先加入固体难溶物CdCO3,不久沉淀由浅色转化为黄色的CdS,而溶液中SO32-却无损失,其原因___________________,写出有关的离子方程式___________________________。
16.(10分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
 (1)滴定
(1)滴定
①用 式滴定管盛装c mol/L盐酸标准液。右图表示某次
滴定时50 mL滴定管中前后液面的位置。请将用去的
标准盐酸的体积填入③表空格中,此时滴定管中液体的体积
mL。
②下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
该实验应选用 作指示剂;
③有关数据记录如下:
|
滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
|
滴定前 |
滴定后 |
消耗的体积 |
||
|
1 |
 V V |
0.50 |
25.80 |
25.30 |
|
2 |
V |
|
|
|
|
3 |
V |
6.00 |
31.35 |
25.35 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测
定结果 。
15.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L-1的NaHSO3
溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com