
题目列表(包括答案和解析)
9.下图中A至F是化合物,G是单质
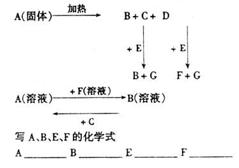
写A、B、E、F的化学式
A B E F
8.BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中,铋具有最外层8电子稳定结构,③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂化合物。且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是 和 。
(2)BGO晶体的化学式是 。
(3)BGO晶体中所含铋氧化物的化学式是 。
7.2000年在河南发现世界级特大金红石(含TiO2)矿床。钛和钛合金及其重要化合物,在许多领域具有广泛、重要的应用,被称为2l世纪的金属。
(1)钛元素的同位素有:2246Ti;2247Ti;2248Ti;2249Ti;2250Ti,则下列说法正确的是 ( )
A.据此可知中子数可能为30 B.据此可算出钛元素的相对原子质量为48
C.钛元素在元素周期表中位于第四周期 D.钛与铁(26Fe)同为第Ⅷ族元素
(2) TiO2 (二氧化钛)是高级的白色颜料,它可用下列反应制得:
第一步:FeTiO3+2H2SO4═TiOSO4+FeS04+2H20
第二步:TiOSO4+2H2O═TiO2。H2O+H2SO4-Q(Q>0)
制氧化钛的关键是第二步反应。根据平衡移动原理,为使第二步反应能够顺利进行。应采用 等措施。
6.元素形成氢化物,特别是lA、11A族活泼金属更是如此,例如钙和氢气在一定温度下发生反应,可生成氢化钙。活泼金属氢化物在熔融态时能导电。金属氢化物与水剧烈反应生成氢气,是优良的氢气发生剂。例如,氢化锂在高温下与二氧化钛反应可得到金属钛TiO2+2LiH高温Ti+2LiOH
由金属元素和氢元素形成的二元化合物叫做金属氢化物,几乎所有的金属元素都能和氢化合。根据以上事实,回答下列问题:
(1)常温常压下,金属氢化物呈 态;理由是 ;
(2)写出钙与氢气反应的化学方程式,并写出电子转移的数目和方向 ;
(3)写出氢化钙与水反应的化学方程式 ;
(4)金属氢化物在化学反应中常用作 剂。
5.在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有四座工厂:甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeC13、Ca(OH)2、HCl中的一种,某中学环保小组对河水监测发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清。④丁处产生气泡,河水仍清,请回答:
(1)四座工厂排出的废液里含有的污染物是:
甲 、乙 、丙 、丁 。
(2)在丁的下游M处取出的河水中,肯定含有的离子是 。
(3)小河中鱼虾几乎绝迹的原因是 。
4.在我国南方某些地区,原本澄清透明的井水在水缸中久置后,水面会出现一层棕红色的“锈皮”,并有少量棕红色絮状沉淀积于缸底,当地居民常采用往水中加明矾的方法来处理这个问题。
(1)井水久置后,缸底出现的棕红色絮状沉淀的主要成分是(写化学式) 。
(2)用化学方法鉴别该井水的步骤是 ,离子方程式是
。
(3)用化学方法鉴别经明矾处理后的水的步骤是 ,离子方程式是 。
3.呼吸面具中Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2也可起到同样的作用。
(1)写出K02与CO2的反应方程式
(2)lkgNa2O2和lkgKO2,分别和CO2反应,生成的O2体积比(同温同压下)为 。
(3)等物质的量的CO2分别与足量的Na2O2,KO2反应生成的O2体积比(同温同压下)为
。
(4)你认为选用 作补氧剂更为合适,理由是 。
2.在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:
NH4++A102-+H2O=Al(0H)3↓+ NH3↑
试回答:
(1)硫酸铝铵在水溶液中的电离方程式为
(2)在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀逐渐减少。请回答各种现象由先到后出现的顺序是(用序号回答): ;
(3)写出滴入氢氧化钠溶液的过程中,有关反应的离子方程式:
① ;
② ;
1.铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
(1)写出制取铁酸钠的化学方程式: 。
(2)在制取铁酸钠的反应中 元素被氧化。
(3)铁酸钠之所以有净水作用,除杀菌外,另一个原因是 。
18.两份铝屑,第一份与盐酸反应,第二份与NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则第一份与第二份铝屑的质量比为 ( )
A.1:l B.1:2 C.1:3 D.2:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com