
题目列表(包括答案和解析)
4.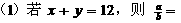 25℃,pH=x的盐酸aL与pH=y的NaOH溶液bL恰好中和(x≤6、y≥8)。
25℃,pH=x的盐酸aL与pH=y的NaOH溶液bL恰好中和(x≤6、y≥8)。
(2)若x+y>14,则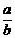 = ;(用x、y表示)且a= b(“>”“<”“=”)
= ;(用x、y表示)且a= b(“>”“<”“=”)
3.准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.60mL |
|
第二次 |
0.20mL |
18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3测出的盐酸浓度 (填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? 填 “是”或“否”)
2.已知某溶液中含有4种离子:A+、B一、H+、OH一,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B+组成物质的化学式(只写一种情况,可以是一种溶质,或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)[B- ]>[A+]>[H+]>[OH- ]:
(2)[A+]>[B- ]>[OH- ]>[H+]:
(3)[H+]>[B- ]>[A+]>[OH- ]:
1.25℃时,若体积为Va、pH=a的某一无强酸与体积为Vb、pH=b的某一元强碱恰好中和,且已知是Va<Vb和a=0.5b,请填写下列空白
(1)a值可否等于3(填“可”或“否”) ,其理由是 。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
(3)a的取值范围是 。
30.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH- ]+2[A2-]
D.在Na2A溶液中一定有:[Na+]>[A2-]>[H+]>[OH- ]
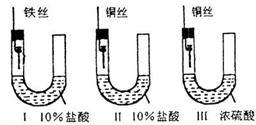
29. 为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是 ( )
A.装置Ⅰ左侧的液面一定会下降 B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重 D.装置Ⅲ中的铁钉几乎没被腐蚀
28.下图是电解CuCl2溶液的装置。其中c、d为石墨电极,则下列有关的判断正确的是 ( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
27.按装置的图进行实验,若右图的x轴表示流入阴极的电子的量,则y轴不可能表示的是 ( )
A.Ag+物质的量浓度
B.NO3-物质的量浓度
C.溶液的pH
D.银棒的质量
26.若200mL[H+]=1×10-3mol·L-1的某一元酸和100mL[OH一 ]=l×10-3mol·L-1的某一元碱溶液相混合后,溶液呈碱性。所用的酸和碱应是
A.等浓度的弱酸和强碱 B.稀的强酸和稀的强碱
C.稀的弱酸和浓的强碱 D.稀的强酸或浓的弱碱
25.下列溶液,一定呈中性的是 ( )
A.[H+]=l×10-7mol·L-1的溶液 B.pH =pOH的溶液
C.pH =14-pOH的溶液 D.[H+]=[OH- ]=l×10-6mol·L-1的溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com