
题目列表(包括答案和解析)
18.(10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO
B.CO2+H2O +NaClO===NaHCO3+HClO
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:_________________________
___________________________________________________________________;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是_______________________,
请写出反应的离子方程式:____________________________________________。
17.(10分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:

请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。 c(Na+)-c(A-)= mol/L
16.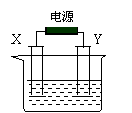 (10分)如图, X和Y均为电极石墨:
(10分)如图, X和Y均为电极石墨:
(I)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为: ;
电解过程中 极(填阴或阳)附近会出现红色;
(II)若电解液为500mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g 。
(1)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,需加入一定量的 (填加入物质的化学式)。(假设电解前后溶液的体积不变)
(2)请你推测原溶液中所含的酸根离子可能是 ;并设计实验验证你的推测,写出实验的操作步骤、现象和结论: 。
15.(10分)盐酸、硫酸和硝酸是中学阶段常见的三种酸。请就三种酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。
 某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?
(填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?
(填“同意”或“不同意”),原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:
。
14.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率 随时间变化的如下图所示。下列说法中正确是 ( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率 随时间变化的如下图所示。下列说法中正确是 ( )
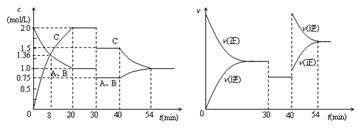
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为4
非选择题
13.科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的选项是 ( )
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是Cu(OH)2
D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
12.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
10.下列离子方程式中正确的是 ( )
A.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
|
C.用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-= H2O+BaSO4↓
D.用饱和纯碱溶液溶解苯酚:CO32-+C6H5OH→HCO3-+C6H5O-
 11.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,
11.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,
则曲线a、b、c、d所对应的实验组别
可能是 ( )
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
9.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是 ( )
A.0.5g C3H4中含有共用电子对的数目为0.1×6.02×1023
B.3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1×6.02×1023
C.25℃时pH=1的醋酸溶液中含有H+的数目为0.1×6.02×1023
D.标准状况下,2.24L CHCl3含有的分子数为0.1×6.02×1023
8.已知下列反应的热化学方程式为 ( )
(1)C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
(3)H2(g)+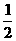 O2(g)=H2O(l)
ΔH 3=-285.8kJ/mol
O2(g)=H2O(l)
ΔH 3=-285.8kJ/mol
2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为
A.488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.244.15 kJ/mol
不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或二个选项符合
题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,
只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com