
题目列表(包括答案和解析)
7.下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.F2、Cl2、Br2、I2的熔、沸点逐渐升高
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.金刚石的硬度大于硅,其熔、沸点也高于硅
6.某无色溶液中加入铝粉产生氢气,则该溶液中肯定能大量共存的离子是
A.Na+、NH4+、SO42-、NO3- B.Fe3+、Mg2+、Cl-、SO42-
C.Na+、K+、Cl-、SO42- D.K+、Na+、AlO2-、MnO4-
5.血液属于胶体,透析是除去肾衰竭病人血液中的毒性物质,从而拯救病人生命的重要方法。透析原理是
A.蒸发 B.电泳 C.过滤 D.渗析
4.非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将N2O5、SO3、CO2、Cl2O7等归为一类.则下列氧化物与它们属于同一类的是:
A.CO B.NO2 C.NO D.SO2
3.氯水中存在多种微粒,下列有关粒子的表示方法正确的是
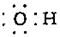
A.氯气的电子式:Cl:Cl B.氢氧根离子的电子式:
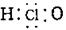
C.次氯酸分子的结构式:H-O-Cl D.HClO的电子式:
2.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等它们互称为
A.同系物 B.同素异形体 C.同分异构体 D.同位素
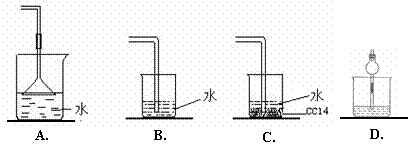
1.已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于氨气吸收的是
21.(12分)短周期元素D、E、X、Y、Z原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 ;Z的核外电子排布式是 。
(2)D的最高价氧化物与E的一种氧化物为等电子体,写出E的氧化物的化学式 。
(3)D和Y形成的化合物,其分子的空间构型为 ,
D原子的轨道杂化方式是 。
X与Z构成物质的晶体类型为 晶体。
(4)写出一个验证Y与Z的非金属性强弱的离子反应方程式 ;
(5)金属镁和E的单质在高温下反应得到的产物与水反应生成两种碱性物质,该反应的化学方程式是 ;
20. (12分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+
2N2(g)
Si3N4(s)+ 6CO(g)
(12分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+
2N2(g)
Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
 (3)若知上述反应为放热反应,则其反应热△H
0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。
(3)若知上述反应为放热反应,则其反应热△H
0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。
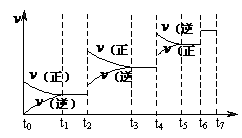
(4)达到平衡后,改变某一外界条件(不
改变N2、CO的量),反应速率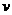 与时
与时
间t的关系如右图。图中t4时引起平衡
移动的条件可能是 ;图中
表示平衡混合物中CO的含量最高的一
段时间是 。
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是多少?(写出计算过程) 提示:272 = 729
19.(8分)A、B两种物质都是由H、N、O、Na四种元素中任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性。请找出A和B可能的两种组合。要求:
①浓度相同时,第一种组合A溶液的pH大于第二种组合中A溶液的pH;
②当这两种组合中的B溶液的pH相等时,第一种组合的B溶液中水的电离程度小于第二种组合的B溶液中水的电离程度。
写出可能有的组合中A与B的化学式。
第一种组合:A ________________;B__________________;
第二种组合:A_________________;B__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com