
题目列表(包括答案和解析)
21.(9分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:

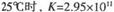
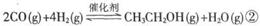 ,
, 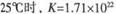
(1).写出反应①的平衡常数表达式K= ▲
(2).条件相同时,反应①与反应②相比,转化程度更大的是 ▲ 。
以CO2为原料合成乙醇的优点是 ▲ 。(写出一点即可)
(3).在一定压强下,测得反应①的实验数据如下表:
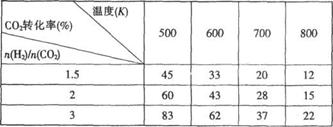
根据表中数据分析:
①.温度升高,K值 ▲ (填“增大”、“减小”或“不变”)。
②.提高氢碳比 ,对生成乙醇 ▲ (填“不利”或“有利”)
,对生成乙醇 ▲ (填“不利”或“有利”)
 (4).在右图的坐标中作图说明压强变化对反应①的化学平衡的影响。图中
(4).在右图的坐标中作图说明压强变化对反应①的化学平衡的影响。图中
横坐标的含义是 ▲ ,
纵坐标含义是 ▲ 。
20.(9分)一种新型高效净水剂PAFC--聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
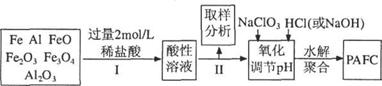
请回答下列问题:
(1).下列关于PAFC的说法中正确的是( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(2).步骤I中加入过量稀盐酸的目的一方面是使固体完全溶解,另一方面是 ▲ 。
(3).步骤II中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3
D.测定溶液中A13+的含量
(4).写出向溶液中加入NaClO3时,发生反应的离子方程式为 ▲ 。
该化工厂的化验室为测定产品PAFC中Al和Fe两种元素的含量,进行下列试剂的选择和基本操作:
(5).测定时所需的试剂有 ▲ 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6).测定时,直接测定的是 ▲ 和 ▲ 的质量(填化学式)。
(7).在测定过程中的操作顺序是 ▲ (按操作顺序选择填写)。
A.萃取 B.分液 C.过滤 D.蒸发 E.洗涤 F.称量 G.灼烧 H.冷却
19.(8分)下表是元素周期表的一部分,请从下表①-⑩十种元素中选择适当的元素回答下列问题:
|
族 周期 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
|
一 |
① |
|
|||||
|
二 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
三 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1).写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式 ▲ ;
(2).已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的离子方程式 ▲ ;
(3).元素⑨形成的单质中存在的化学键为 ▲ ;
(4).物质熔沸点的高低与该物质的晶体结构有关,④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 ▲ 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,现用实验证明上述猜想是否正确,你的实验方案是 ▲ 。查阅资料发现B的熔点远低于NaCl的熔点,则B的晶体类型是 ▲ 。
18.(8分) (1).1840年,俄国化学家盖斯(Hess)指出:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这就是著名的“盖斯定理”。现已知在101KPa下CH4、H2、C(固)的燃烧热分别为890.83KJ ·mol-1、285.83 KJ·mol-1和393.51 KJ·mol-1,则反应C(s)+2H2(g)=CH4(g)的反应热△H= ▲ ,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义 ▲ 。
 (2).氯化银在水中存在沉淀溶解平衡:
(2).氯化银在水中存在沉淀溶解平衡:
25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.1mol·L-1盐酸中;③100 mL 0.1mol·L-1氯化铝溶液中;④100 mL 0.1mol·L-1氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是 ▲ (填写序号)。在0.1mol·L-1氯化铝溶液中,银离子的浓度最大可达到 ▲ mol·L-1。
17.(8分)A、B、C、D是中学常见的纯净物,它们之间的转化关系如图所示:

(1).若A是由短周期中原子半径最大的元素构成的单质;D由短周期元素组成,既可溶于NaOH溶液又可溶于盐酸,则D的化学式为 ▲ 。
(2).若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式为 ▲ ;将等物质的量的C与A通入NaOH溶液无气体剩余,写出该反应的离子方程式: ▲。
(3).若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离子;D不溶于稀硝酸。A与B反应的离子方程式是 ▲ 。
16.(10分)某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。
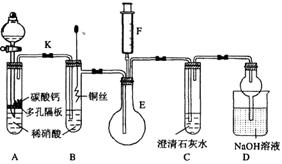
请回答有关问题:
(1).设计装置A的目的是 ▲ ;
为达到此目的,应进行的操作是 ▲ 。
(2).在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ▲ ;B中反应的离子方程式为: ▲ 。
(3).装置E和F的作用是 ▲ ;为实现此作用,其操作方法是 ▲ 。
(4).装置D的作用是 ▲ 。
15.(10分)(1)下列有关实验的叙述中,合理的是 ▲ (填序号)
A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
B.构成右图所示装置时,盐桥中的K+ 向左池移动
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
D.配制10%的ZnSO4溶液时,可将l0 g ZnSO4·7H2O溶解在90 g水中
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定含有SO42-
F. 配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高。
(2).配制90mL 1 mol·L-1的Na2CO3溶液,需称取 ▲ g Na2CO3固体,简述用托盘天平称取该质量Na2CO3的操作步骤(天平已调平) ▲ 。
(3).现有0.1mol·L-1的纯碱溶液,用离子方程式表示该纯碱溶液呈碱性的原因: ▲ 。为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案 ▲ 。
14.工业上可用下列反应来制取纯硅:
反应①:Si(粗硅)+3HCl(g)=SiHCl3(l)+H2(g) 反应②:SiHCl3(l)+H2(g) = Si(纯硅)+3HCl(g)
假设在每一轮次的投料生产中,硅元素无损失,反应①中HCl的利用率为60%,反应②中H2的利用率为80%。则下一轮次的生产中,需补充投入HCl 和H2的体积比为
A. 4 ︰1 B. 8︰1 C. 2︰3 D. 3︰5
 第II卷(非选择题 共72分)
第II卷(非选择题 共72分)
13.元素A的单质及A与B形成的化合物能按如下图所示的关系发生转化。则下列说法正确的是
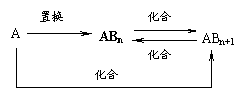

A.图中物质间的转化都是氧化还原反应 B.当n=1时,A可能是N2
C.A一定是金属元素 D.当n=2时,A可能是Fe
12.下列溶液中有关物质的量浓度关系正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com