
题目列表(包括答案和解析)
19.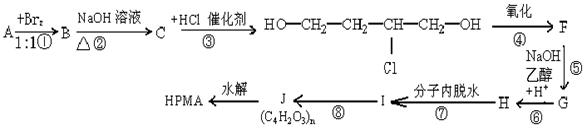 已知水解聚马来酸酐得到的有机物HPMA被普遍用在锅炉中作阻垢剂。按下图步骤可以用不饱和烃A合成HPMA
已知水解聚马来酸酐得到的有机物HPMA被普遍用在锅炉中作阻垢剂。按下图步骤可以用不饱和烃A合成HPMA
(1)写出结构简式:A ,C 。
(2)反应①属于 反应,反应②属于 反应。(填反应类型)
(3)写出②、⑧反应的化学方程式
②
⑧
(4)在上述合成路线中,有人提议略去③④⑤⑥反应,由C直接制得H而使实验简化,请你评价该建议是否合理?理由是什么?
理由是: 。
18.下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为有颜色的固体。
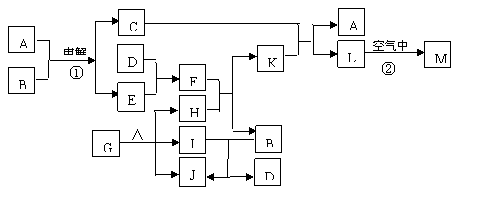
(1)写出:A的电子式 ,J的结构式 ,M的化学式 。
(2)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(3)写出K和E反应的离子方程式 。
写出F溶液和H反应的离子方程式 。
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为 。
17.(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a= mol·L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为
。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。

16.科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如下。
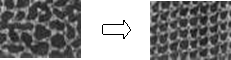
水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是 分子。请你展开想象,给“热冰”设计一个应用实例 。
(2)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是 。
②由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式 。
15.化学课外活动小组设计了如图所示的一套气体发生、
收集和尾气吸收装置,以探究该装置的多功能性能。
(1)甲同学认为装置Ⅰ可作为实验室制氧气的快速发
生器,则装置Ⅰ的a仪器中可加入 或 ,
b仪器中加入 或 (与a中分别
对应)。装置Ⅱ从 管口进气即可作为O2的收集装置。
(2)丙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
(3)戊同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入___________试剂,b仪器中加入________ 试剂,装置Ⅲ中应加入适量的 试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
14.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
第二卷(非选择题 共72分)
13.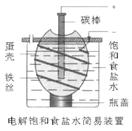 右图为电解饱和食盐水的简易装置,下列有关说法正确的是
右图为电解饱和食盐水的简易装置,下列有关说法正确的是
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
12.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
11.在下述条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Ba2+、I-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.c (HCO3-)=0.1 mol·L-1的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、SO32-、Na+
10.下列各溶液中,微粒的物质的量浓度关系正确的是
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com