
题目列表(包括答案和解析)
27.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
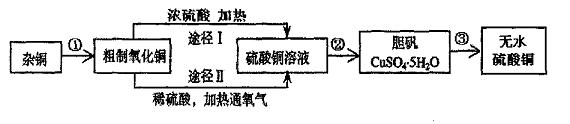
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编吓填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a蒸发皿 b石棉网 c泥三角 d表面皿 e坩埚钳 f试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
a灼烧过程中部分氧化铜被有机物还原与铜
b灼烧不充分铜未被完全氧化
c氧化铜在加热过程中分解生成铜
d该条件下铜无法被氧气氧化
(3)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II优点有 (填序号)。
①产生等量有胆矾,II耗酸量比I少
②II不产生有毒气体
③用相同量含有粗铜的氧化铜,II比I制得的胆矾多
(4)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行
次
(5)若测定结果x值偏高,可能的原因是 。
a加热温度过高 b胆矾晶体的颗粒较大
c加热时胆矾晶体溅出 d胆矾晶体部分风化
(6)实验室中若要完成步骤③,一般将胆矾放在 (填仪器的名称)加热。实验中往往由于操作不当,得到的无水硫酸铜是灰色的,通过分析可知灰色粉末成分是硫酸铜和 (填化学式)组成的混合物
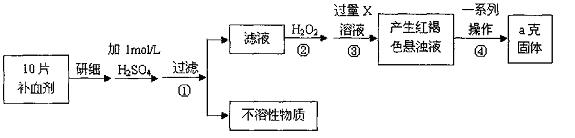
26.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O为片剂。
25. 有可逆反应A(g)+3B(g) 2C(g)+Q(Q>0)
有可逆反应A(g)+3B(g) 2C(g)+Q(Q>0)
(1)写出该反应的平衡常数表达式: ;升高温度,平衡常数K将 。(填“增大”,“减小”,“不变”)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20min后又达新平衡。试推测,与原平衡状态相比,第15min时,V正 (填“增大”,“减小”,“不变”),V逆 (填“增大”,“减小”,“不变”)。
(3)该反应的速率与时间的关系如下图所示:
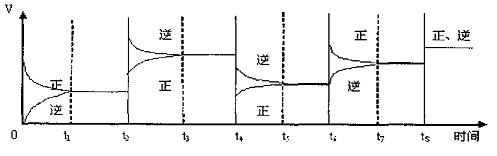
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,试判断改变的是什么条件:
t2时 ;t4时 ;t6时 ;t8时 。
24.现有部分短周期元素,对其描述如下表:
|
元素编号 |
元素描述 |
|
W |
所处周期数、族序数都与其原子序数相等 |
|
X |
其氢化物可作致冷剂 |
|
Y |
原子核外p电子数比s电子数多1,且原子半径小于X |
|
Z |
单质与冷水剧烈反应,且反应后溶液呈碱性 |
(1)元素X的原子核外有 种不同形状的电子云。
(2)元素Z离子的核外电子排布式: 。
(3)元素X、Y与W形成化合物的稳定性: > 。(用化学式表示)。
X与W形成化合物的电子式 ,Y与W形成化合物质 分子(填极性或非极性)
(4)元素W、Z形成化合物时,W的化合价是 价。
(5)X最高价氧化物对应的水化物与其氢化物反应产物可用作化肥,该物质长期使用而造成土壤呈酸性,其原因是 。(用离子方程式表示)
23.某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这种五种物质组成一个合理的未配平的方程式:
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:
(3)pH为5-9时,体系中的氧化反应为HI→I2;当pH<4时,反应方向改变,此时体系中的氧化反应为: → 。
(4)该反应表明溶液的酸性影响物质是 (填物质的性质)。
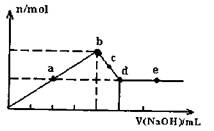
22.向MgC12和A1C13的混合溶液中加入氢氧
化钠溶液,所得沉淀的物质的量(n)与加
入氢氧化钠溶液的体积(V)关系如右图所
示。则下列说法正确的是 ( )
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b点溶液的中c(Na+)=c(C1-)
C.b-c段与c-d段溶液中阴离子的物质的量相等
D.在d点,向溶液中加入盐酸,沉淀量将减少
第Ⅱ卷(共84分)
21.某同学测得物质的量浓度均为0.01mol/LCH3COOH和CH3COONa混合溶液呈酸性后,得出了关系式,你认为其中不正确的是 ( )
A.c(CH3COO)>c(CH3COOH)
B.c(CH3COO)>c(Na+)>c(H+)>c(OH-)
 C.c(Na+)=c(CH3COO-)=0.01mol/L
C.c(Na+)=c(CH3COO-)=0.01mol/L
D.c(CH3COOH)+c(CH3COO-)=0.01mol/L
20.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,其中叙述正确的是 ( )
A.分别加水稀释10倍,两溶液的pH仍相等
B.温度下降10℃,两溶液的pH均不变
C.加入适量的氯化铵晶体后,两溶液的pH均减小
D.用相同浓度的盐酸中和,消耗盐酸的体积相同
19.将一定量的铁粉和硫粉的混合物隔绝空气共热,充分反应冷却,再加入足量稀H2SO4,得到标准状况下的气体11.2L,则原混合物中的可能组成为 ( )
|
|
物质的量关系 |
混合物总质量 |
|
A |
n(Fe)<n(S) |
>44g |
|
B |
n(Fe)>n(S) |
=44g |
|
C |
n(Fe)=n(S) |
>44g |
|
D |
n(Fe)>n(S) |
<44g |
18.右图是气体制取装置,下列能用此装置
制取气体能“随开随用、随关随停”的
是 ( )
A.大理石和稀盐酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和电制取乙炔
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com