
题目列表(包括答案和解析)
6.下列实验方案合理的是
A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
B.测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放入锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定
C.用分液漏斗分离苯与硝基苯
D.用蒸馏的方法分离乙醇和乙酸
5.右表为元素周期表中短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是
A.A与B形成的阴离子可能有:AB32-、A2B42-
|
|
|||
|
A |
|
B |
C |
|
|
|
|
D |
E |
|
B.C的氢化物的沸点比E的氢化物的沸点高
C.D在过量的B中燃烧的主要产物为DB3
D.由这5种元素中的几种形成只含极性键的非极性分子不少于4种
4.下列离子方程式书写正确的是
A.小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
3.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
2.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.在标准状况下,2.24L HF中所含有的分子数约为6.02×1022
B.3.2克的Cu与足量的浓硝酸反应生成的气体分子数约为6.02×1022
C.含有6.02×1023个中子的D2O的质量为2.0g
D.pH=1的硫酸氢钠溶液中的硫酸根离子数约为6.02×1022
1.下列各项关系正确的是
A.熔点:K>Na>Li B.离子半径:Mg2+>F->O2-
C.热稳定性:NaHCO3>Na2CO3>CaCO3 D.酸性:HClO4>HBrO4>HIO4
31.为了防环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH3HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4SO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积):
|
实验序号 |
样品质量(克) |
NaOH溶液的体积(mL) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
IV |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为:
; 。
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为 L。
(3)计算确定该混合物中(NH4)2SO4和NH4GSO4的物质的量之比 。
(4)欲计算该NaOH溶液的物质的量浓度应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。
30.将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克。
则
(1)剩余固体是 (化学式),
(2)原混合物中Na2CO3的物质的量是 mol。
(3)已知Na2CO3和稀盐酸反应分两步进行:
Na2CO3+HC1→NaC1+NaHCO, NaHCO3+HC1→NaC1+CO2↑+H2O,若将上述19g混合物溶于适量的水中配成溶液,在该溶液中逐滴加入1mol/L的稀盐酸,用消耗的盐酸体积(mL)作为横坐标,反应产生的CO2的体积作为纵坐标得到如下图像:
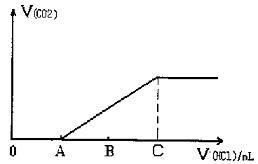
求:A点对应溶液的溶质是 (填化学式);C点时消耗盐酸的体积是 mL。C点时产生的CO2的体积在标况下是 L。
29.茉莉花是一首脍炙人口的民歌。茉莉花香气的成份有多种,乙酸苯甲酯
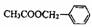
( ),是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇
为原料进行人工合成。一种合成路线如下:
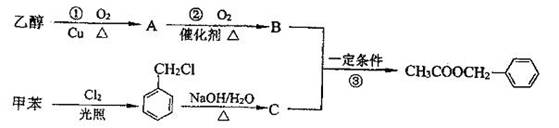
(1)C的结构简式为 。
(2)写出反应①的化学方程式: 。
(3)反应③的化学方程式: 。
其反应类型为 。
(4)反应 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(5)写出符合下列条件的乙酸苯甲酯一种同分异构体:①含苯环结构 ②具有酯的结构: 。
(6)指出乙醇的两个重要用途 、 。
28.乙烯是一种重要的石油化工原料,以乙烯为原料在不同条件下可合成下列物质:
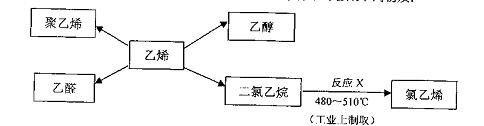
完成下列各题:
(1)工业从石油制取乙烯的方法是 (填编号)
a常压蒸馏 b减压蒸馏 c裂化 d裂解
(2)下列关于聚乙烯的说法正确的是 (填编号)
a取乙烯是混合物 b聚乙烯是乙烯互为同系物
c聚乙烯中含有碳碳双键 d聚乙烯不可用作食品塑料袋
(3)写出乙醇的同分异构体 (写结构简式)
(4)写出反应X的化学方程式 ,该反应类型为 。
(5)证明一瓶乙醛溶液部分被氧化的化学试剂是 (填编号)
a银氨溶液 b金属钠 cNaHCO3溶液 d酚酞试液
(6)已知乙烯分子是平面结构,且双键不能旋转。若分子中两上氢原子被氯原子取代,
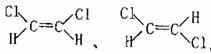
可得到 则这两种分子属于 (填同种物
质或同分异构体)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com