
题目列表(包括答案和解析)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Ag 108
1.分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.依据有否电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.依据能量的变化,将化学反应分为放热反应和吸热反应
D.依据组成元素的种类,将纯净物分为单质和化合物
2.化学与生活密切相关,下列有关说法正确的是 ( )
A.目前加碘食盐中主要添加的是KI
B.生理盐水的浓度为0.9%
C.淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物
D.家庭可以用明矾将自来水净化成纯净水
3.氮化硅陶瓷是一种超硬耐磨物质,可用于制造高性能柴油机发动机部件,它属于( )
A.有机合成材料 B.复合材料 C.无机非金属材料 D.金属材料
4.下列说法不正确的是( )
A.所有的复分解反应都是非氧化还原反应
B.液氨、液氯、液态氯化氢都是非电解质
C.静电除尘利用了胶体能发生电泳的性质
D.使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定
5.下列离子方程式中正确的是( )
A.铜与稀硝酸反应:Cu+2H++NO3-=Cu2++NO↑+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
C.过量的二氧化碳通入漂白粉溶液中:ClO-+CO2+H2O=HClO+HCO3-
D.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
6.根据元素周期表知识,下列说法不正确的是( )
A.最外层电子数为3~7的原子一定是主族元素的原子
B.短周期元素X、Y,若X、Y的最外层电子数相同,且X原子半径小于Y,当X (OH)n为强碱时,Y(OH)n必为强碱
C.短周期元素A、B,若A、B电子层数相同,且A原子半径小于B,当HnAOm为强酸时,B必为活泼非金属元素
D.2007年3月21日,中国科学技术名词审定委员会公布了111号元素Rg的中文名称,111号元素属于过渡元素
7.下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
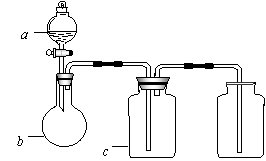
|
编号 |
气体 |
a |
b |
c |
|
A |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
B |
CO2 |
盐酸 |
碳酸钙 |
饱和NaHCO3 |
|
C |
NO |
稀HNO3 |
铜屑 |
H2O |
|
D |
NO2 |
浓HNO3 |
铜屑 |
NaOH溶液 |
8.以下物质的制备原理不正确的是( )
A.无水氯化镁的制备:MgCl2·H2O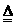 MgCl2+6H2O
MgCl2+6H2O
B.钴的制备:3Co3O4+8Al 9Co+4Al2O3
9Co+4Al2O3
C.烧碱的制备:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
D.漂粉精的制备:2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O
|
3Fe3++2S2O32-+O2+xOH- Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
A.1molFe3+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
B.x=4
C.每生成1molFe3O4,反应转移的电子总数为4mol
D.S4O62-是还原剂
10.一定能在指定环境中大量共存的是( )
A.c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
B.在由水电离出的c(H+) = 1×10-12mol/L的溶液中:Fe 3+、ClO-、 Na + 、SO42-
C.在pH=1的溶液中:NO3-、SO42-、Na+ 、 Fe 2+
D.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
11.若用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.32g臭氧中,含有氧原子2NA
B.在标准状况下,2.24L苯中所含分子数约为NA
C.9gD2O中含有的电子数为5NA
D.7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
12.某溶液含有III中的离子(见下表),欲用I中的试剂来检验溶液是否还含有II中的离子,能够进行成功检验的是(说明:在实验过程中不允许加热、过滤、萃取等操作)( )
|
选项 |
I |
II |
III |
|
A |
稀氨水 |
Al3+ |
Mg2+ |
|
B |
稀硝酸、AgNO3溶液 |
Cl- |
I- |
|
C |
KSCN溶液 |
Fe2+ |
Fe3+ |
|
D |
稀盐酸、BaCl2溶液 |
SO42- |
SO32- |
13.取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于( )
A.8.64g B.9.20g C.9.00g D.9.44g
14.短周期元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。下列说法不正确的是( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的溶液能使酚酞试液变红
B.C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A-E的顺序依次增大
第Ⅱ卷(非选择题 共58分)
15.(9分)某兴趣小组同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1关闭K2,可制取 气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是__________________________________________________;打开K2关闭K1,将A中液体加入B中后,观察到的实验现象为___________________________________。
16.(17分)某品牌消毒液包装说明的部分内容摘录如下:主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。请完成以下实验探究过程:
25.(6分)白色粉末A由NaNO3、Na2SO3、Na2SO4三种物质中的一种或几种混合而成。取A样品,投入100 mL 2.2 mol/L硫酸(过量)中,使它们在密闭容器中充分反应。反应后测得,反应中产生的896mL(标准状况下)纯净的无色气体不能使品红溶液褪色,该气体遇空气变为红棕色;反应后的溶液中只含有一种酸根阴离子,且其物质的量浓度为3.1 mol/L。(设反应后溶液的体积仍为100mL)
(1)反应后溶液中酸根阴离子的化学式为______________。
(2)写出A样品与硫酸反应的离子方程式____________________________。
(3) 原A样品中含有的各物质的物质的量分别为多少?(要求写出简单运算过程)
2009届华中师大一附中高三上学期期中考试
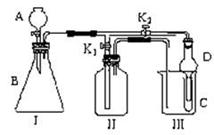
24.(8分)金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失 B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色 D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→_______________________________________→用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是( )
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,用手挤压矿泉水瓶并塞紧带有钠的塞子,共排出水的体积为16.8mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均属于标准状况,则所用的钠的质量为________g。
23.(8分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。为探究X的成分,他们进行了如下实验(图中①、②表示试剂的加入顺序)。
(1)操作Z是 。下列仪器中,在灼烧沉淀时必须用到的仪器名称是 ;
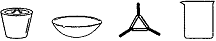
(2)写出向溶液Y中滴加H2O2溶液时发生反应的离子方程式 ;
(3)通过以上数据,得出2.376g黑色粉末X中各成分的物质的量为 。
22.(9分)烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。如图表示两个丙烯分子进行烯烃换位,生成两个新的烯烃分子:2-丁烯和乙烯。
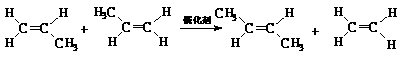
现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
|
|
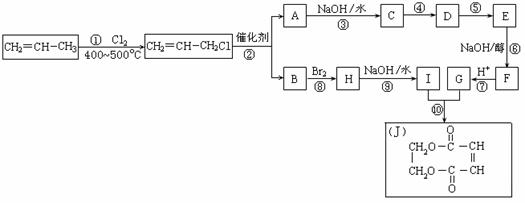
(1)写出下列反应的反应类型:
①______________,⑧______________,
(2)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是_____________________________________________,
(3)写出下列物质的结构简式:A F
(4) 反应⑩的化学方程式是___________________________________________。
21.(9分)已知甲、乙、丙是三种常见单质,且组成它们的三种元素核电荷数之和为35,A 到H是八种常见化合物,E比B的相对分子质量大16。上述各物质间的相互关系见下图所示(反应条件省略)。已知各物质所含元素均为短周期元素。试回答:
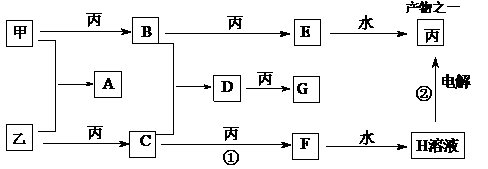
(1)从A到H八种化合物中摩尔质量相同的是 (写化学式)
(2)写出①②两步的化学方程式:
①
②
(3)写出A的电子式
(4)0.8g的乙与丙反应生成C,放出的热量为a kJ,写出该反应的热化学方程式:
20.(8分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.02 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+6 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
–2 |
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)元素③在周期表中位置是 ; 元素④与元素⑦相比较,气态氢化物较稳定的是 (填化学式);
(2)元素①与元素⑥按照原子个数比为1∶1形成的化合物与水反应的化学方程式 ;
(3)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式 ;
(4)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应
19.(6分)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4 - Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
(1)配平上述反应的化学方程式;
(2)上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
(3)写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
18.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
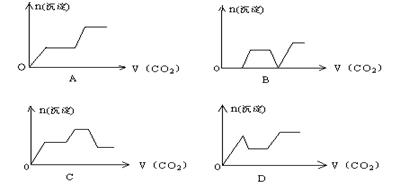
第Ⅱ卷(非选择题 共54分)
17.浅绿色的Fe(NO3)2溶液中,存在水解平衡:Fe2++2H2O Fe(OH)2+2H+。若在此溶液中加入盐酸,则溶液颜色
Fe(OH)2+2H+。若在此溶液中加入盐酸,则溶液颜色
A.浅绿色略变深 B.颜色基本不变 C.变为红褐色 D.变黄
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com