
题目列表(包括答案和解析)
5.检验溶液中是否含有某种离子,下列操作及判断正确的是 ( )
A.加入AgNO3溶液,有白色沉淀生成,证明含有Cl-
B.加入NaOH溶液析出白色沉淀,继续加过量NaOH溶液沉淀又消失,证明含有Al3+
C.加浓NaOH溶液后加热,产生使润湿的红色石蕊试纸变蓝色的气体,证明含有NH4+
D.加入盐酸,放出使澄清石灰水变浑浊的气体,证明含有CO32-
4.下列五种粉末状物质:硅胶、氧化镁、碳酸钠、硫酸铝、氢氧化铝,为了鉴别它们,除有蒸馏水外,还必须使用的一组试剂是 ( )
A.NaOH溶液和CO2 B.盐酸和NaOH溶液 C.盐酸和CO2 D.BaCl2溶液和硫酸
3.为了区别五种无色溶液HCl、AlCl3、NaCl、Ba(NO3)2、Na2CO3,四位同学都没用酒精灯,三位同学另用了试剂,一位同学没用任何试剂,其中操作步骤最少的是( )
A.甲另用酚酞试液 B.乙另用NaOH溶液 C.丙另用石蕊试液 D.丁不用任何试剂
2.下列各组文章中不易用物理性质区别的是 ( )
A.苯和四氯化碳 B.酒精和汽油 C.氯化铵和硝酸铵晶体 D.碘和高锰酸钾固体
1.下列各组稀溶液,不用其它试剂或试纸,仅利用溶液间的相互反应,就可以将它们区别开来的是( )
A.硝酸钾 硫酸钠 氯化钙 氯化钡 B.硫酸钠 硫酸铝 氯化钠 氢氧化钠
C.盐酸 硫酸钠 碳酸钠 氢氧化钠 D.硫酸氢钠 硫酸镁 碳酸钠 氢氧化钠
26.(9分)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母) 。
a. 同位素 b. 同系物 c. 同素异形体 d. 同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法 。
(3)举出实例说明X的氢化性比硫单质的氧化性强(用化学方程式表示)。
。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是 。
②KCN溶液显碱性,原因是(用离子方程式表示) 。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1g,MmRn质量为w2g,M的相对原子质量为a,则MmRn中m:n= (用含w1、w2和a的代数式表示)。
25.(7分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组
成。X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
(1)Y的电子式是 。
 (2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是
。
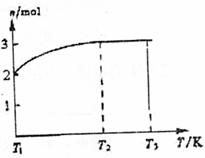
(3)一定温度下,将1mol N2O4置于密闭容器中,
保持压强不变,升高温度至T1的过程中,
气体由无色逐渐变为红棕色。温度由T1继续
升高到T2的过程中,气体逐渐变为无色。
若保持T2,增大压强,气体逐渐变为红棕色。
气体的物质的量n随温度T变化的关系如图
所示。
①温度在T1~T2之间,反应的化学方程式是 。
②温度在T1~T2之间,气体的平均相对分子质量是(保留1位小数) 。
23.(10分)原子序数递增的部分短周期主族元素的原子半径数据如下表:
|
元素 |
A |
B |
D |
E |
F |
G |
M |
N |
P |
|
原子半径/nm |
0.077 |
0.075 |
0.074 |
0.071 |
0.186 |
0.160 |
0.143 |
0.102 |
0.099 |
(1)已知A、B、D、E、N、P为非金属元素,在周期表中的位置如下,请将相应元素符号填在表中。
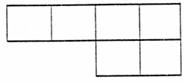 (2)B在周期表中的位置为
,
(2)B在周期表中的位置为
,
AD2的电子式为 。
(3)N的最高价氧化物的水化物与A单质反应的
化学方程式为 。
(4)M的最高价氧化物的水化物是药物“胃舒平”
的主要成分,可以治疗胃酸过多,反应的离子
方程式为 ,F的最高价氧化物的水化物也可以中和胃酸,不用其治疗胃酸过多的原因是
。
(5)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,反应的化学方程式为
。
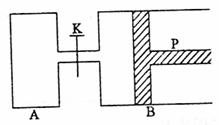
 24.(6分)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中均各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)
2Z(g)+2W(g),达到平衡时,VB=0.6aL。
24.(6分)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中均各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)
2Z(g)+2W(g),达到平衡时,VB=0.6aL。
试回答下列问题:
(1)B中X的转化率为 。
(2)A、B中的X的转化率的关系是A B(填“>”,“=”,“<”),理由是
。
(3)平衡时A、B中混合气体的平均相对分子质量的关系是:MA MB(填“>”,“=”,“<”)
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的数据是 (填写字母)(MX、MY、MZ、MW分别表示X、Y、Z、W的摩尔质量)。
①MX ②MY ③MZ ④MW
A.③和④ B.①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B的体积为 L
22.(14分)
(1)2008年北京奥运会火炬的每一处设计都体现着“人文奥运”“科技奥运”和“绿色奥运”的理念。与往届奥运会火炬的混合燃料不同,北京奥运会火炬使用燃料为环保燃料丙烷。完全燃烧2.2g丙烷,恢复至常温,放出550kJ的热量,写出表示丙烷燃料热的热化学方程式 ;
(2)足量铜与一定量浓硫酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗此NaOH溶液的体积是 。
(3)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和K2MnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。试回答:
①软锰矿制备K2MnO4的化学方程式是
②K2MnO4制备KMnO4的离子方程式是
(4)一定量的氢气在氯气中燃烧,所得混合物用100mL3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
①原NaOH溶液的质量分数为
②所得溶液中的Cl-的物质的量为 mol
③所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=
21.(14分)
(1)中和热的测定实验(如图)。
①量取反应物时,取50mL 0.50mol·L-1的盐酸,
还应加入的试剂是 (填序号)。
A.50mL 0.50mol·L-1NaOH溶液
B.50mL 0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
②在实验过程中,该同学需要测定并记录的实
验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL 0.50mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据 。(填“偏大”或“偏小”或“不变”)
(2)硫酸铜晶体(CuSO4·xH2O)结晶水含量的测定实验。
①称量一定质量硫酸铜晶体后,加热脱结晶水时用到的仪器主要有:玻璃棒、三角架、坩埚钳、泥三角和 。
②实验中要将坩埚放在干燥器中冷却,其主要目的是 。
③若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中x= (写表达式)。
④如果实验中加热温度过高,固体颜色变黑,则测定结果会 (填“不变”或“偏高”或“偏低”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com