
题目列表(包括答案和解析)
20.将20克NaOH固体溶解于足量水中,并通入足量CO2气体,生成的溶液中各微粒浓度关系正确的是 ( )
A.
B.
C.
D.c(OH -)=c(H +)+c(HCO3-)+c(H2CO3)
18.如图所示,四个装置中电极反应式相同的一组是 ( )
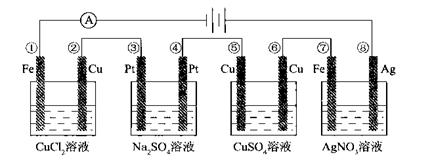
A.①⑦ B.②⑥ C.③④ D.⑤⑧
19.在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
|
容
器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( )
A.Q1=2Q2=2Q3=197KJ
B.在上述条件下每消耗2摩SO2气体时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
17.下列有关工业生产的叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2.H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
16.下列离子方程式书写完全正确的是 ( )
A.过量澄清石灰水中通入CO2气体:CO2+OH-=HCO3-
B.少量盐酸加到小苏打溶液中:H++HCO3-=H2O+CO2↑
C.铁与足量稀HNO3溶液反应:Fe+8H++4NO3-=Fe2++4NO↑+4H2O
D.MgSO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
15.一定温度下,在固定容积的密闭容器中,可逆反应:
 mA(气)+nB(气) pC(气)+qD(气),当m.n.p.q为任意正整数时,下列状态:①体系的压强不再发生变化,
mA(气)+nB(气) pC(气)+qD(气),当m.n.p.q为任意正整数时,下列状态:①体系的压强不再发生变化,
②体系的密度不再发生变化,
③各组分的物质的量浓度不再改变,
④各组分的质量分数不再改变,
⑤反应速率vA:vB:vC:vD=m:n:p:q,
其中,能说明反应已达到平衡的是 ( )
A.只有③④ B.②③④ C.①②③④ D.①②③④⑤
14.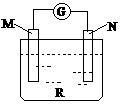 如右图:电流计的指针会偏转,M极变粗,
如右图:电流计的指针会偏转,M极变粗,
N极变细符合这种情况的是 ( )
A.M是铜,N是锌,R是硫酸溶液
B.M是锌,N是铜,R是硫酸铜溶液
C.M是银,N是锌,R是硝酸银溶液
D.M是铁,N是铜,R是硝酸铜溶液
13.有一铁的“氧化物”样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L氯气,恰好使其中Fe2+离子全部转化为Fe3+离子,该样品可能的化学式是( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
12.下列各组离子不能大量共存的是 ( )
A.Fe2+.NH4+.SO42-.NO3- B.Ba2+.Na+.NO3-.OH-
C.Al3+.K+.SO42-.I- D.Fe3+.NH4+.NO3-.I-
11.在容积不变的某2L的密闭容器中,充入5molH2与N2的混合气体,在一定条件下,5min后反应达到平衡,此时容器内的压强是反应前的4/5。则下列说法不正确的是( )
A.从反应开始到平衡时,用H2表示平均反应速率为0.15mol·L-1·min-1
B.反应达到平衡时,NH3的物质的量浓度是0.5mol·L-1
C.反应达到平衡时,N2和H2的物质的量比一定为1:3
D.反应达到平衡时,反应物和生成物的总的物质的量的比为3:1
10.盐酸.醋酸和碳酸氢钠是生活中常见的物质,关于它们下列表述正确的是 ( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH-
B.等物质的量浓度的NaHCO3和Na2CO3溶液的PH前者大于后者。
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com