
题目列表(包括答案和解析)
6. NA为阿伏加德罗常数,下列叙述中不正确的是
A. 5.6g铁与足量的硫完全反应,失去电子的数目约为0.2NA
B. 1L 0.01mol/L的氯水中含有的分子总数大大超过0.01NA
C. 0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.2NA
D. 含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2:3
5.下列各组离子,在指定的环境中能大量共存的是 A. 在酸性溶液中:Na+、K+、MnO4-、S2O32- B. 在中性溶液中:Al3+、K+、SO42-、HCO3- C. 25℃时pH=0的溶液中:Al3+、NH4+、NO3-、HSO3- D. c(H+)< c(OH-)的溶液中:Na+、K+、SO32-、S2-
4.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-四种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液的体积不变)
A. CH3COO- B. SO32- C. CO32- D. HCO3-
3.下列有关气体体积的叙述中,正确的是
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体.若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
2.依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
A.依据元素的原子序数,推断该元素原子的核外电子数
B.依据物质相对分子质量,推断物质熔、沸点的高低
C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小
D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性
1.在化学反应中,反应前与反应后相比较,肯定不变的是
①元素的种类 ②原子的种类 ③分子的数目 ④原子的数目
⑤反应前物质的质量总和与反应后物质的质量总和
⑥如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
A.①②③④ B.①②⑤⑥ C.①②④⑤ D.②③⑤⑥
28、将25.6g Cu投入150mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标准状态)NO和NO2的混合气体,求反应中消耗的硝酸的物质的量?
27、氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。
⑴将标准状况下11.2L氨气溶于100mL水中,得到密度为0.855g·cm-3的氨水。求所得氨水的物质的量浓度。
⑵将上述30mL氨水与70mL2mol·L-1的AlCl3溶液混合,求生成的沉淀质量。
26、下面是某同学在学习硫元素的学习方案.
(1)硫元素的原子结构示意图是 _____________ ,从结构可以知道硫元素是一种典型的非金属元素.
(2)硫单质的物理性质,硫是一种淡黄色的 体(气、液、固),主要存在于火山喷发口附近或地壳的岩层里,这是硫以游离态形式存在于自然界中,硫元素在自然界中也有以化合态形式存在,如许多金属矿石是含硫化合物,如胆矾 ________________________(填化学式)。
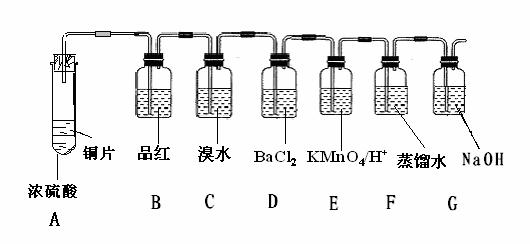 (3)设计如下实验探究硫和含硫化合物的相互转化:
(3)设计如下实验探究硫和含硫化合物的相互转化:
(Ⅰ)完成下列各个反应的化学方程式
①A中在加热时发生的反应
②C中的反应
(Ⅱ)记录观察到的实验现象
①B中品红试液由红色变为 ,加热后又 ,
(结论:可以根据该现象用品红试液来证明SO2的存在与否)。
②D 中没有观察到什么现象,在实验结束后往D中滴加H2O2后
则可以看到 。
③E 中溶液现象是:___________________________
而在该反应中SO2是 剂(氧化、还原)。
(Ⅲ)G的作用是吸收尾气,写出反应的离子方程式
(Ⅳ)F溶液在放置一段时间后,其pH变小的理由,是因为:
25、依据下列物质的转化关系图,填写以下空格。
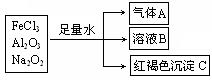
(1)A的化学式为 ;C的化学名称为 。
(2)溶液B中主要含有的阴离子是 ______________ ;
(3)产生气体A的化学方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com