
题目列表(包括答案和解析)
2. 下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
1. 运动会上使用的发令枪,所用火药的成份是氯酸钾和红磷,经撞击发出响声并同时产生白色烟雾,此时发生的反应为:5KClO3 + 6P == 3P2O5 +5KCl,则下列有关叙述错误的是( )
A.上述反应中消耗3molP时,转移15mol电子
B.上述反应中氧化剂和还原剂的物质的量之比是5:6
C.因红磷和白磷互为同素异形体,所以在此火药中可以用白磷代替红磷
D.产生白色烟雾的原因是生成的P2O5为白色小颗粒(烟)吸水性很强,吸收空气中水分,部分生成磷酸小液滴(雾)
25.小苏打、胃舒平都是常用的中和胃酸的药物。
(1)小苏打每片含0.504g NaHCO3,2片小苏打片和胃酸完全中和,被中和的H+的物质的量是多少?
(2)胃舒平每片含0.234g Al(OH)3。中和胃酸时,6片小苏打片相当于多少片胃舒平?
(写出计算过程)
河南省实验中学2008-2009学年上期期中试卷
24.某学生利用以下装置探究氯气与氨气之间的反应。其中A,F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
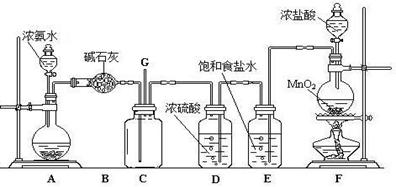
请回答下列问题:
(1)装置F中发生反应的离子方程式为 ;
(2)B装置的名称是 ;E装置的作用 ;
(3)通入C装置的两根导管左边较长、右边较短,目的是 ;(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: ;当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为(用含a、b的代数式表示) 。
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
23.在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 ;Y所形成的酸性最强的含氧酸的化学式为 ;Y所在主族元素中氢化物沸点最高的物质化学式为 。
(2)元素Z与Y同主族,其氢化物的水溶液是一种弱酸,在实验室中通常保存在塑料瓶
而不能保存在玻璃瓶中,其原因为 (用
化学反应方程式表示);Z2与NaOH溶液反应的产物之一是OZ2,该反应的化学方程
式为 。
22.甲、乙、丙、丁和戊五种溶液,分别由NH4+、K+、Al3+、Ag+、Ba2+和Cl-、Br-、NO3-、SO42-、CO32-中的一种组成(离子不重复出现)。其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
(1)根据上述事实推断上述溶液中溶质的化学式:
甲 ,乙 ,丙 ,丁 ,戊 。
(2)写出甲和乙反应的离子方程式 。
21.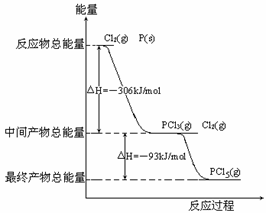 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据右图回答下列问题:
(1)原子最外层电子均达到8电子结构的分子是
(选填“PCl3”或“PCl5”)。
(2)P和Cl2反应生成PCl3的热化学方程式
______ _。
(3) PCl5分解成PCl3和Cl2的热化学方程式__________________ _ 。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________ ___ __。
20.某反应体系的物质有:H2SO4、KMnO4、MnSO4、CO2、K2C2O4、K2SO4、H2O。
(1)请将上述物质填入以下空格内,组成一个配平的化学反应方程式。

(2)上述反应中,被氧化的元素是_______,氧化产物是____________。
(3)当有1mol的氧化剂参加反应时,转移的电子数是_______mol。
19.下图是周期表的一部分,根据元素的性质和递变规律,回答下列问题。
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
⑤ |
|
|
||||||||
|
|
① |
|
② |
⑥ |
|
③ |
④ |
Ar |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)1-20号元素中,属于金属元素的有________种,金属性最强的元素与⑤元素的单质反应生成的化合物有___________(填两种化合物的化学式)。
(2)写出③元素的离子的核外电子排布示意图____________________。
(3)比较①②③④形成的单核离子的半径大小_____>_____>_____>_____(写离子符号)
(4)第三周期中,原子半径最大的是(稀有气体除外)______________ (填元素符号);
(5)推测⑤⑥最简单氢化物的稳定性_________大于_________(填化学式)。
(6)分别写出含有③号元素的某种18电子的微粒和含有⑤号元素的两种10电子的离子间反应的离子方程式:________________________,_________________________。
18.取500mL Na2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3 : 2 。则碳酸钠溶液的物质的量浓度为
A.0.4mol/L B.0.3mol/L C.0.2mol/L D.0.5mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com