
题目列表(包括答案和解析)
13.下列离子方程式不正确的是
A.用NaOH溶液吸收足量H2S气体:OH +H2S==HS
+H2S==HS +H2O
+H2O
B.NH4HCO3溶液中加入足量NaOH溶液:NH +OH
+OH ==NH3·H2O
==NH3·H2O
C.标准状况下112mL Cl2缓慢通入1mol/L FeBr2溶液10mL:
2Fe2++4Br +3Cl2==2Fe3++2Br2+6Cl
+3Cl2==2Fe3++2Br2+6Cl
D.CaCO3溶于CH3COOH:CaCO3+2CH3COOH==Ca2++2CH3COO +H2O+CO2 ↑
+H2O+CO2 ↑
12.Cl2、SO2均能使品红溶液褪色。后者因为品红分子结构中的发色团遇到亚硫酸后结 构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
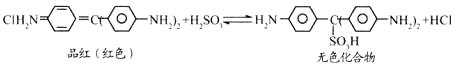
下列说法正确的是
A.品红溶液中同时通入Cl2、SO2,漂白效果会更好
B.加热可判断品红褪色是通入SO2还是通入Cl2引起的
C.“无色化合物”分子中,19个碳原子都可能在同一平面上
D.品红分子结构中,19个碳原子都可能在同一平面上
11.在100g浓度为18mol/L、密度为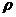 g/cm3的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
g/cm3的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
A.大于100mL
B.小于100mL C.等于100mL D.等于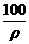 mL
mL
10.室温下,某无色透明溶液中由水电离出来的H+和OH 浓度的乘积为1×10
浓度的乘积为1×10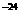 ,则此溶液中可能大量共存的离子组为
,则此溶液中可能大量共存的离子组为
A.HCO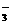 、Al3+、Na+、SO
、Al3+、Na+、SO B.I
B.I 、NO
、NO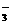 、K+、NH
、K+、NH
C.MnO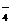 、Cl
、Cl 、SO
、SO 、K+ D.SiO
、K+ D.SiO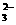 、SO
、SO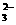 、Na+、Cl
、Na+、Cl
9.下列叙述正确的是
A.微粒间以分子间作用力结合的晶体,其熔点不会很高
B.正四面体构型的分子中,键角一定为109°28′
C.离子晶体中含有离子键,也可能含有共价键
D.金属阳离子只能与阴离子构成晶体
8.下列化学反应中|△H|的数值(放热)最大的是
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(1);△H1
B.NaOH(aq)+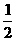 H2SO4(aq)==
H2SO4(aq)== 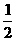 Na2SO4(aq)+H2O(1);△H2
Na2SO4(aq)+H2O(1);△H2
C.CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O(1);△H3
D.NaOH(aq)+ 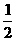 H2SO4(浓)==
H2SO4(浓)== 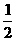 Na2SO4(aq)+H2O(1);△H4
Na2SO4(aq)+H2O(1);△H4
7.将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A. 11.20L B.15.68L C.22.40L D.31.36L
6.以NA表示阿伏加德罗常数,下列说法中正确的是
A.1.8g NH 离子中含有的电子数为NA
离子中含有的电子数为NA
B.常温常压下,1mol甲基(-CH3)所含电子数为10NA
C.25℃,1.01×105 Pa下,使V L氯化氢气体溶于水得V L水溶液,所得溶液的物质的量浓度为1/22.4mol/L
D.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2NA
5.教材是学习的重要材料,但不能迷信教材。下列是中学化学教材中摘录的部分表述内容,根据你所学的化学知识判断,其中不够科学严密的是
A.除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚 沉。
B.离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离 子反应。
C.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
D.不同的化学反应,具有不同的反应速率,这说明,参加反应的物质的性质是决定化学反应速率的重要因素。
4.化学是以实验为基础的自然科学,化学实验没计和操作中必须十分重视师生安全问题和环境保护问题。下列实验问题处理方法正确的是
A.制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
B.在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度
C.白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱
D.给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com