
题目列表(包括答案和解析)
2. 下列离子方程式不正确的是
A. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液: 2Fe2++H2O2+2H+=2Fe3++2H2O
C.铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4 H2O
D.向次氯酸钙溶液中通入少量二氧化碳:Ca2++2ClO-+CO2+H2O=2HClO+ CaCO3↓
1. 下列说法正确的是
A. 多数合金的熔点一般比组成合金的各成分金属高
B. 变色玻璃中的一种是含有溴化银和微量氧化铜的玻璃
C. 红宝石、蓝宝石和金刚石都是由碳元素组成的宝石
D. 光导纤维的主要成分是硅,可广泛用于通信和医疗领域
25.(10分)如图所示,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2molY,起始时,VA=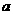 L,VB=0.8
L,VB=0.8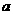 L(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自均发生下述反应:
L(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自均发生下述反应:
3X(g)+3Y(g) 2Z(g)+2W(g),达到平衡时,VB=0.6
2Z(g)+2W(g),达到平衡时,VB=0.6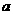 L。
L。

(1)B中X的转化率为 。
(2)A、B中X的转化率的关系是A B(填“>”“=”或“<”),其理由是 。
(3)平衡时A、B中混后气体的平均相对分子质量的关系是:MA MB(填“>”“=”或“<”)
(4)打开K,一段时间后反应再次达到平衡,如果要计算出此时B容器中混合气体的密度。则至少还需要知道以下数据组合中的 组(填选项字母)。(设MX、MY、MZ、MW分别表示X、Y、Z、W的摩尔质量)
A.Mz和Mw B.MX和MY C.Mx和Mz D.MY和MW
写出其密度的一种表达式:
g·L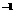 。
。
2008学年启东中学高考模拟试卷(十)
24.(8分)亚硝酸盐广泛存在于自然环境中,如蔬菜、肉类、豆类等都可以测出一定量的亚硝酸盐,一般情况下,当人体一次性摄取得300-500 mg亚硝酸钠时,就会引起中毒。某研究性学习小组用碘量法测定泡菜中亚硝酸盐的含量,反应方程式如下: 2NaNO2+2H2SO4+2KI==2NO+I2+K2SO4+Na2SO4+2H2O,2Na2S2O3+I2==Na2S4O6+2NaI。取l kg泡菜榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的亚硝酸盐都成为亚硝酸钠,在过滤后的滤液中加入氢氧化铝乳液,以除去色素,再次过滤后得到滤液,将该滤液稀释至1L,取25.00 mL菜汁与过量的稀硫酸和碘化钾溶液的混合液反应,再选用合适的指示剂,用较稀的硫代硫酸钠溶液进行滴定,共消耗0.050 mol·L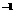 Na2S2O3溶液20.00 mL。请回答下列问题:
Na2S2O3溶液20.00 mL。请回答下列问题:
(1)该实验中可选用的指示剂是 。
(2)通过计算判断若某人一次食入0.125 kg这种泡菜,是否会引起中毒?
(3)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害,主要是因为橙汁中含有丰富的维生素C,说明维生素C具有 性。
23.(10分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经图所示途径合成化合物D(分子式为C3H6O3)。

请回答下列问题:
(1)写出下列物质的结构简式:A ;B ;C ;D 。
(2)指出反应②的反应类型: 。
(3)写出反应③的化学方程式: 。
(4)反应④的目的是 。
(5)化合物D′是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D′在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D′生成E和F的化学方程式:
D′→E: 。
D′→F: 。
22.(8分)L一多巴是一种有机物,它可用于帕金森综合症的治疗,其分子式为:C9H11N。 这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。已知含碳、氢、氧、氮4种元素的有机物在空气中完全燃烧生成二氧化碳、水和氨气。
(1)L一多巴分子在空气中燃烧的化学方程式是 。
(2)若烃C7H12和C5H12的混合物1 mol在空气中完全燃烧时消耗的氧气为9 mol,则混合物中C7H12和C5H12的质量比为 。
(3)若某烃的含氧衍生物0.1 mol在空气中完全燃烧时消耗的氧气的物质的量与等物质的量的L一多巴分子完全燃烧时消耗的氧气相同,且生成二氧化碳17.92L (标准状况),则该烃的含氧衍生物通式为
(用含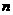 的化学式表示)。
的化学式表示)。
21.(10分)甲醛溶液久置会产生分层现象,上层为无色油状液体,下层为水溶液,经测
定,上层物质为甲醛的聚合物(CH2O) ,该分子中无醛基,且沸点比水高。已知:(CH2O)n→nCH2O(酸性环境中)
,该分子中无醛基,且沸点比水高。已知:(CH2O)n→nCH2O(酸性环境中)
(1)甲醛溶液置于空气中易被氧化,证明甲醛已被氧化的实验操作和现象是
。
(2)有人用下图a所示装置制取甲醛:烧瓶装(CH2O)n和6mol/L稀硫酸溶液,加热至沸腾,(CH2O)n分解,产生的甲醛气体被锥形瓶中的蒸馏水吸收,则冷凝管的进水方向为 (填“a”或“b”),从冷凝管中回流的液体是 ,导气管未插入锥形瓶液面下的原因是 。
常温下甲醛有毒,是致癌物和致畸形物之一。我国规定,居室空气中的甲醛的最高容许浓度为0.08mg/m3,某化学研究小组用如下方法测定居室中的甲醛的浓度(设空气中无其他还原性气体)。
测定原理:酸性高锰酸钾可氧化甲醛和草酸,其离子方程式为:
4MnO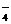 +5HCHO+12H+==4Mn2++5CO2↑+11H2O
+5HCHO+12H+==4Mn2++5CO2↑+11H2O
(
)MnO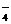 +(
)H2C2O4+( )H+→(
)Mn2++( )CO2↑+(
)H2O
+(
)H2C2O4+( )H+→(
)Mn2++( )CO2↑+(
)H2O
测定装置如图b所示。
实验步骤:
(3)检查装置的气密性,如何检查装置的气密性?
。
(4)用 (填仪器名称)取足量酸性高锰酸钾溶液装入广口瓶中。
(5)打开a,关闭b,用注射器抽取100 mL新装修室内的空气,关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应,再如此重复多次,如果压人气体的速度过快,对测定结果如何影响?
。

(6)用草酸滴定广口瓶中的溶液,(填“要”或“不要”) 指示剂,终点的实验现象是 ,若高锰酸钾的浓度为c1,体积为V1mL,草酸的浓度为c2,消耗草酸溶液的平均体积为V2 mL,则甲醛的浓度是 mg/m3。(设抽取的空气体积为100mL)
19.(8分)下表是三个不同短周期部分元素的原子半径及其主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位于 。
(2)写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应: 。
(3)X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e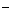 结构,且含有非极性键)的电子式: 。
结构,且含有非极性键)的电子式: 。
第一步:称取m g样品,放入250mL烧杯中,加适量水溶解
第二步:
计算样品中含KCl·MgCl2·6H2O(相对分子质量为277.5)的质量分数的表达式:
。
18.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”中制取NaHCO3的实验步骤:
第一步:连接好装置图(如下),检查气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后C中出现固体,继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。
请回答下列问题:
(1)装置的连接顺序是:(a)接( )( )接( );(b)接( )。
(2)A中常选用的固体为 ;D中应选用的液体为 ;B中发生反应的化学方程式为 。
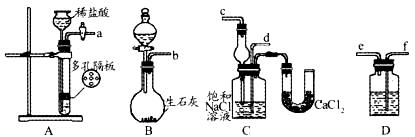
(3)第二步中必须让 装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是 ,C中广口瓶内发生反应的化学方程式为 。
(5)第四步中分离出NH4Cl晶体的操作是 ;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3 (约占5%-8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl,简要写出操作和现象: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com