
题目列表(包括答案和解析)
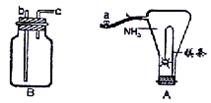
26.全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应:
①Mg+2NH3-点燃→Mg(NH2)2+H2+O2
 ②Mg+NH3-点燃→MgNH+H2+O2
②Mg+NH3-点燃→MgNH+H2+O2
(1)如上图装置A所示,镁条在HN3中燃烧时,先落下的残渣主要是Mg(NH2)2,后落下的残渣主要是MgNH。其原因是_____________________________。
(2)为了使残渣中Mg(NH2)2生成得更多,可以在镁条燃烧前打开弹簧夹a,并将导管与充满_____气体的装置B连接,连接的导管接口为________(填编号“b”或“c”),理由是_____________
(3)将固体残渣在盛有水的烧杯中加热至沸腾后,Mg(NH2)2和MgNH完全水解,产生Mg(OH)2和NH3。为了确保Mg(NH2)2和MgNH全部转化为Mg(OH)2,加热过程中必要的操作是___________________。
(4)将沉淀过滤、洗涤、烘干后,称得Mg(OH)2的质量为0.435g。又测得装置B中剩余气体的密度为氢气的10倍,体积为224ml(以上数据均折算成标准状况)。由此可推算出残渣中各物质的量之比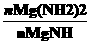 =___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是__________________________。
=___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是__________________________。
25.在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。
(1)第二周期的碳,氮,氧,氟都可以形成氢化物,氧原素的氢化物除H2O外,还有H2O2;碳原素的氢化物除CH4外,还有C2H6等。与之相似的氮元素的氢化物的分子式为__________,起沸点比液氨____(填“高”或“低”),稳定性比氨_____( 填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为_______。
(2)氮原子间也可形成链状结构,假设氮原子间只以N-N键形式连接,并形成氢化物,则该系列氢化物的通式为_____。
(3)1998年,美国科学家卡尔.克里斯特合成了具有高能量的正离子N5+是一种“V”字形的结构,在N5+中每个氮原子最外层都满足“8电子稳定结构”,整个结构中含有两个N≡N键,推测N5+离子的结构式为:______。
24.560℃时,在恒容密闭容器中发生如下反应:CO(g)+H2O(g)→CO2(g)+H2(g)+Q。起始浓度[CO]=0.02mol/L,[H2O] mol/L,达到平衡后,CO的转化率为50%。
(1)若升温到660℃时,平衡常数K____1(填<or>or=)。
(2)560℃时,在恒容密闭容器中,若起始浓度[CO]=0.01 mol/L,[H2O]=0.03 mol/L,达到平衡时,H2O的转化率____50%(填<or>or=)。
(3)达到上述平衡后,在恒温恒容情况下,往容器中充入适量的H2S气体,重新达到平衡时,H2O的转化率_____50%(填<or>or=)。理由是__________________________
23.将NaBiO3固体(黄色微溶)加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[]NaBiO3+[]MnSO4+[]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
(1)配平上述反应的化学方程式、
(2)上述反应中被氧化的元素是____________,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将_______molHCL氧化成CL2.
(3)写出NaBiO3固体溶于HCL时发生反应的离子方程式____________。
22.实验室进行下列实验,在选择实验装置时应当考虑冷凝回流装置的是 ( )
A.苯与液溴在铁的催化下制溴苯 B.用蒸馏烧瓶从石油中提取汽油
C.葡萄糖与银氨溶液共热制眼镜 D.乙醇、乙酸与浓硫酸共热制乙酸乙酯
21.在pH为4-5的环境中,Cu2+和Fe3+不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右。在漫漫加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是 ( )
A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5
B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5
C.向溶液中通入Cl2,在通入NH3调节至pH4-
D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5
20.现有两种金属的混合物共4克,与足量氯气反应后,固体增重7.1克。另取4克该金属混合物,投入到足量盐酸中,产生2.24L(S.T.P)H2.则该混合物的组成不可能是 ( )
A.Cu,Al B.Mg,Fe C.Zn,Al D.Mg,Zn
19.在以恒温恒容容器中,充入2molA和1molB发生反应:2A(g)+B(g)→xC(g),达到平衡后,C的体积分数为W%.若起始时充入0.6molA、0.3molB、1.4molC,达到平衡后,C的体积分数仍为W%,则x的值可能是 ( )
A.1 B.2 C.3 D.4
18.已知某溶液中存在OH-,H+,NH4+,Cl-四种离子,四位同学分别测定气浓度大小关系如下,其中不可能正确的是 ( )
A.Cl->NH4+>H+>OH- B.Cl->H+>NH4+>OH-
C.NH4+>OH->Cl->H+ D.OH->H+>Cl->NH4+
16.MgBr2和MgO的混合物共10g,经分析,其中Mg原素的质量分数为38.4%,则Br元素的质量分数为 ( )
A.30% B.40% C.50% D.46%
 17.20mL HCl和H2SO4的混合溶液中,含 Cl-和SO42-各0。004mol,将此溶液进行导电性实验。向混合溶液中浊滴滴入0.2mol/L Ba(OH)2溶液,测的电流强度I与所加入Ba(OH)2溶液体积V的关系正确的是 ( )
17.20mL HCl和H2SO4的混合溶液中,含 Cl-和SO42-各0。004mol,将此溶液进行导电性实验。向混合溶液中浊滴滴入0.2mol/L Ba(OH)2溶液,测的电流强度I与所加入Ba(OH)2溶液体积V的关系正确的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com