
题目列表(包括答案和解析)
7.可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志是
在体积固定的密闭容器中进行,达到平衡状态的标志是
① 单位时间内生成n mol的O2同时生成2nmolNO2
② 单位时间内生成n molO2时生成2n mol NO
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率的比为2:2:l的状态
A.①③④⑥ B.②③⑤⑦ C.①③④⑤ D.全部
6.下列离子方程式不正确的是
A.Fe(ON)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.4mol-L-1的NaAlO2溶液和7mol-L-1的HC l等体积互相均匀混合
4A1O2-+7H++H2O=3AI(OH)3 ↓+A13+
C.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
D.氯气通入热的氢氧化钠溶液 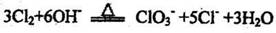
5.下列过程或现象与盐类水解无关的是
A.用明矾净水
B.用TiCl4制备TiO2
C.实验室用SnCl2固体配制其溶液时,常用盐酸溶解而不用蒸馏水
D.烧菜用过的铁锅,经放置后常出现红棕色的斑迹
4.一定条件下,向一带活塞的密闭容器中充入2mol SO2和lmolO2,发生下列反应:
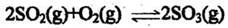 达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.保持温度和容器体积不变,充入1mol SO2(g)
B.保持温度和容器内压强不变,充入1mol SO3(g)
C.保持温度和容器内压强不变,充入1mol O2(g)
D.保持温度和容器内压强不变,充入1molAr(g)
3.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是
A.具有吸附性 B.溶解度与CuS、PbS、CaS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、.CdS
2.已知Cr(OH)3在有水体系中存在如下平衡
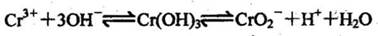
紫色 灰绿色 亮绿色
若向0.05mol/L的Cr2(SO4)3溶液50mL中,加入0.5mol/L的NaOH溶液50mL,充分反应后溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
1.在浓盐酸中H3AsO3与SnCl2反应离子方程式为:
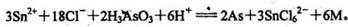 关于该反应的说法中正确的组合是
关于该反应的说法中正确的组合是
① 氧化剂是H3AsOs;
② 还原性:C了->As;
③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;
④ M为OH-;⑤SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
科学家致力于CO2的“组全转化”技术研究,把过多的CO2转化为有益于人类的物质。如果将CO2和H2以一定的体积比混合,通入反应器,在适当条件下反应,可获得重要的能源物质和水。
(1)标准状况下,将14LCO2与56LH2混合,在反应器中恰好完全反应,生成的气体可使碱石灰增重22.5克。则上述反应中可获得的能源物质是______。
(2)调整CO2与H2混合时的体积比,可以得到不同的烃类。为了得到一种重要的工业原料,控制VCO2/VH2=1/3,则生成的烃类中最简单的是________。
(3)在170~200℃时,用钴作催化剂,可生成C5~C8的烷烃,这是人工合成汽油的方法之一。在合成汽油的反应中VCO2/VH2,的关系为______
31.向含有Na2O2的密闭容器中通入一定量O2与C2H6的混合气体后,用电为花引燃,直至所有物质间的反应完全为止,冷却至室温后,容器内压强似近为零。
(1)若通过的O2和C2H6的体积比在最小值所发生的化学反应的总方程式:
Na2O2+C2H6+O2→
(2)当Na2O2的质量为2.34g时,通入的O2的物质的量的最大值为_____mol.
(3)当通入的气体为1molC2H6和xmolO2时,Na2O2的物质的量为____mol(有含X的表达式表示)。
 (4)在右图中画了生成三种产物的总物质的量y(mol)随通入O2的物质的量xmol的不同而变化的函数图象。
(4)在右图中画了生成三种产物的总物质的量y(mol)随通入O2的物质的量xmol的不同而变化的函数图象。
(5)当Na2O2与O2的物质的量相等时,各产物的物质的量之和为_____mol。
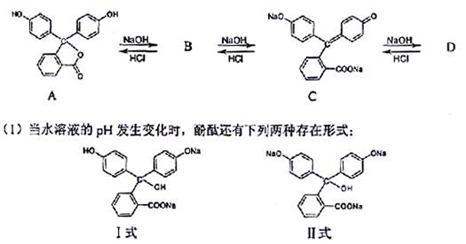 28.酚酞(C20H14O4)在碱性溶液中显红色,是带两个单位负电荷的离子,其结构中三个六元碳环处于同一平面上。酚酞在水溶液中存在下列转化关系:
28.酚酞(C20H14O4)在碱性溶液中显红色,是带两个单位负电荷的离子,其结构中三个六元碳环处于同一平面上。酚酞在水溶液中存在下列转化关系:
在上述转化关系中,酚酞为:___,I式为_____,显红色的是___(均填写“A””B”C”D”)。
(2)煤焦油中的芳香烃X(C8H10)经过下列转化可以合成酚酞:

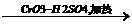
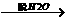
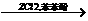
其中CrO3-H2SO4可将苯环的侧链氧化,Y为无色晶体,分子组成为C8H6O4,能溶于NaHCO3溶液,1molY脱1mol水可得到1molZ,Z在ZnCl2的作用下与苯酚反应得到酚酞。写出Z与苯酚反应的化学方程式:_____________________。
29.①卤化烃在氢氧化钠存在时,发生水解:R-X+H2O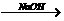 R-OH+HX
R-OH+HX
②羧酸在磷的催化作用下,可以与卤素反应,生成α-卤代物:
RCH2COOH+Cl2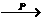 RCHClCOOH+HCl
RCHClCOOH+HCl
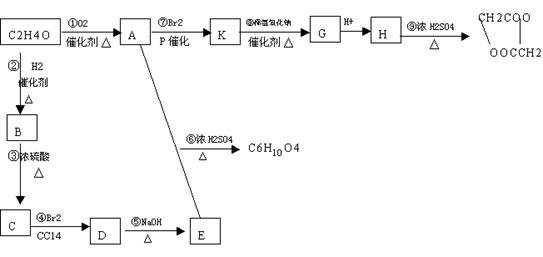 现有下列转化关系:
现有下列转化关系:
(1)上述转化中,属于加成反应的是________(填序号),属于取代反应的是__________(填序号)。
(2)只用H作为单体可以合成高分子化合物,写了同义该高分子化合物的结构简式:_________________________。
(3)写出下列反应的化学方程式:
③______________________________⑥_____________________________。
27.美国计划2015年再次登陆月球,继而在月球上建立基地,给人类登陆火星作准备。为了早日实现梦想,1992年美过进行了第一次利用实际的月球岩石来制造氧气的试验。科学家们采用了10克富含钛铁矿(FeTiO3,钛酸亚铁)的玄式岩,作如下处理:
研究发现:理论上,lkg FeTiO3被H2还原后,最多可产出105g O2。对反应之后的玄武岩进行仔幻分析表明,其他月球矿石也能用于辅造氧气。在玄武岩中仅占很小一部分的橄榄石MgFe[SiO4]也被大量还原了;许多月球岩石中主要成分之一的辉石,如LiAl[Si2O6](锂辉石)被还原得很少;许多月球岩石中共有的斜长石,如Li[AlSi4O10](透锂长石)几乎未被还原。
(1)FeTiO3,被H2还原后,生成Fe、________________________和水。
(1)为了进一步探明月球上可提取氧的蕴藏量以及分布情况,1997年发射的月球探测器用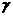 射线光谱仪测量了月球上________元素的含量,为预估氧产量提供了足够精确的数据。
射线光谱仪测量了月球上________元素的含量,为预估氧产量提供了足够精确的数据。
(2)大量研究结果表明,从月球土壤中同样可以提取氧。由单独的、平均直径为抑40微米的小圆珠组成的火山玻璃(富含Fe2SiO4)是最适合在月球上造氧的矿物。这种火山玻璃作为造氧原料的优点为________________________________。
 上述研究引起了两位学生的极大兴趣,查阅文献后,得知钛铁矿还能被C还原:2FeTiO3+C→2Fe+2TiO2+CO2。他们分别设计了两套实验装置模拟测定钛铁矿中可提取氧的质量分数的实验。
上述研究引起了两位学生的极大兴趣,查阅文献后,得知钛铁矿还能被C还原:2FeTiO3+C→2Fe+2TiO2+CO2。他们分别设计了两套实验装置模拟测定钛铁矿中可提取氧的质量分数的实验。
(4)学生甲设想用图-1装置(A为电加热装置)从钛铁矿中提取氧,请写出最简便的实验步骤:__________________________(选填下列数字编号)
①通入N2;②停止通N2;③通入H2;④停止通H2;⑤加热;⑥停止加热;⑦称取装置B的质量。
(5)学生乙设想用图-2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO2可通过绿色植物的光合作用转化为营养物质,同时产生氧气(6O2+6H2O-光合作用→C6H12O6+6O2)。实验过程中,称得反应前装置B中钛铁矿的质量为a克,炭粉的质量为b克,反应后装置B中产生CaCO3的质量为c克,则钛铁矿中可提取氧的质量分数的表达式为___________。
(6)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图-2装置在加热时,还会产生CO,给实验带来误差。请提出对图-2所示装置应采取的改进措施:__________________________________。改进后,实验自始至终需持续向z装置A中通入N2的目的是_________________________________________。
(7)科学家们选用H2而不用CO作还原剂的原因是:_______________________。另据资料显示,钛铁矿被还原的化学过程,早已被人类使用过教百年,推测当时人们利用该反应原理进行生产的目的是_____________________ _____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com