
题目列表(包括答案和解析)
17.为确定某溶液的离子组成,进行如下实验:
① 测定溶液的pH,溶液显强碱性。
② 取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③ 在②反应后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④ 取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀:
根据实验以下对原溶液中存在离子的推测正确的是
A.一定有SO32-离子 B.一定有O32-离子
C.Cl-离子一定存在 D.不能确定HCO3-离子是否存在
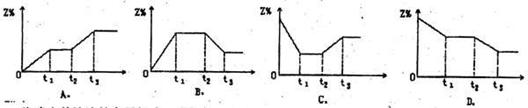
16.在一是条件下,可逆反应: ,在tl时刻达到平衡,然后在t2时刻开始加热到一定温度后停止加热并保温,到t3时刻又建立平衡,下图能表示这一变化过程的是
,在tl时刻达到平衡,然后在t2时刻开始加热到一定温度后停止加热并保温,到t3时刻又建立平衡,下图能表示这一变化过程的是
15.一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:
C2H5OH+3O2=2CO2+3H2O,电池示意图如图。
下面对这种电池的说法正确的是
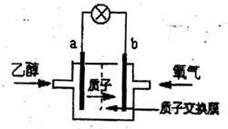 A..b极为电池的负极
A..b极为电池的负极
B.电池工作时电子由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.设每个电子所带电量为q库仑,则l mol乙醇被氧化产生6NAq库仑的电量
14.常温下,0.1 mol L-1某一元酸(HA)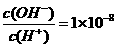 ,下列正确的是
,下列正确的是
A.该溶液中由水电离出的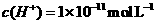
B.0.1mol/L的NaA溶液中的离子浓度大小关系为:
C.该溶液中水的离子积常数为l×10-12
D.用0.1 mol L-1 NaOH溶液V1L与0.1 mol·L-1该一元酸(HA)V2L溶液混合,若混合溶液的pH=7,则V1<V2
13.已知: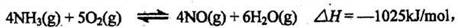 该反应起一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
该反应起一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是 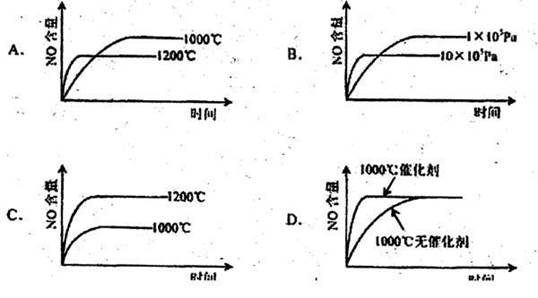
12.已知反应:①101kPa时,2C(s)+O2(g)= 2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-- (aq)=H2O(1) △ H=-57.3kJ/mo1
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mo1.
B.①的反应热为221kJ/mol
C.含1mol硫酸的稀溶液与含l mo氢氧化钡稀溶液反应放出的热量叫中和热
D.稀盐酸与稀NaOH溶液反应生成l mol水,放出57.3kJ热量 .
11. Na2SO4溶液的溶解度曲线如图,下列说法不正确的是
Na2SO4溶液的溶解度曲线如图,下列说法不正确的是
A.A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4H2O晶体都可使其饱和
B.B、C点表示tl℃时,Na2SO2溶液在B点的溶解度大于在C点的溶解度
C.在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊
D.制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个
且正确的给2分,选两个且都正确的4分,但只要选错一个,该小题就为0分)
10.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,33.6 LH2O含有1.5 NA个H2O分子
B.1.5 mol NO2与足量H2O反应,转移的电子数为NA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
D,0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA
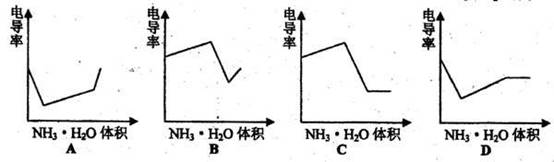
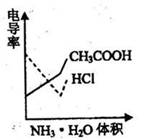
9.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
8.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,
知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
 A.酸 B.漂白剂 C.还原剂 D. 氧化剂
A.酸 B.漂白剂 C.还原剂 D. 氧化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com