
题目列表(包括答案和解析)
1. 红珊瑚栖息于200-2000米的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥富有的象征,一直用来制做珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是:
A..Na B. Fe C. Si D. Cu
26.(12分)
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知: 平衡常数随温度的变化如下表:
平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(填“放热”,或“·吸热”)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
|
|
n (CO) |
n (H2O) |
n (H2) |
n (CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
|
E |
3 |
1 |
2 |
1 |
(3)已知在一定温度下, 平衡常数K;
平衡常数K;
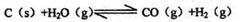 平衡常数K l;
平衡常数K l;
 平衡常数K2
平衡常数K2
则K、Kl、K2之间的关系是: 。
(4)若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,求该条件下CO的平衡转化率。写出计算过程。
(5)在VL密闭容器中通入10 mol CO和10 mo1水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842kJ(己知CO燃烧为283kJ/mol,H2燃烧热为286/kJm01),则T℃平衡常数K= 。
2008-2009学年度华南师大附中高三综合测试
25.(11分)
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究Fe2O3、Cu2O的红色粉末混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4.5H.2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
4.7 |
7.0 |
1.9 |
|
沉淀完全pH |
6.7 |
9.0 |
3.2 |
实验室有下列试剂可供选择:氯水H2O2 NaOH Cu2(OH)2CO3
实验小组设计如下实验方案:
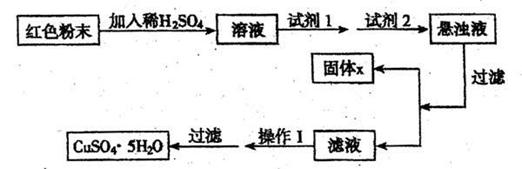
试回答:
(1)请写出红色粉末加入稀H2SO4后,发生反应的离子方程式:
(2)试剂I为 ,你选择的理由是 。
(3)试剂Ⅱ为 ,你选择的理由是 。
24.(12分)
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)-CCl4分离污水中的Cu2+时,先发生络合反应:
 再加入CC14,Cu(HDz)2就很容易被萃取到CC14中。
再加入CC14,Cu(HDz)2就很容易被萃取到CC14中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
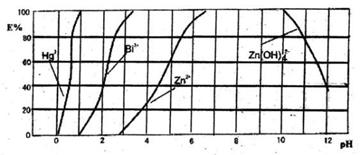
某工业废水中含有Hg2+、Bi2+、Zn2+,用双硫腙(H2Dz)~CC14络合萃取法处理废水。请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=
(3)当调节pH=2时,铋(Bi)的存在形式有: 其物质的量之比为 。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式: 。
23. (9分)
(9分)
甲容器为恒容密闭容器,乙容器为带有可自由移动活塞的恒压密闭容器。现有可逆反应: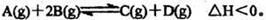 在相同温度下,将1mol A和2tool B加入串容器中,将2mol C~2mo1 D加入乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(C)=1.5 tool/L。请回答下列问题:
在相同温度下,将1mol A和2tool B加入串容器中,将2mol C~2mo1 D加入乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(C)=1.5 tool/L。请回答下列问题:
(1)5 min内,用B物质表示甲容器中的平均反应速率v(B)= 。
(2)平衡后,若甲容器中A的体积分数为M%,乙容器中A的体积分数为N%,则
M: N(填“>”“=”或“<”)。
(3)若使甲容器化学平衡向正反应方向移动,则可以改变的条件是(填写字母) ;改变条件的瞬间, 体系的正反应速率将 。(填“增大”、“减小”、“不变”)
A.减小A的物质的量 B.降低体系的温度
C.增大D的浓度 D.加入催化剂
(4)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙容器中C的物质的量浓度c(C) (填“>’“<’“‘=’’)3 mol/L。
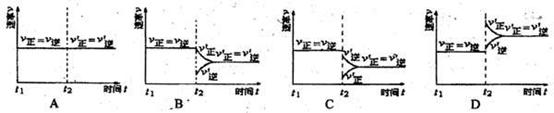
(5)保持温度不变,t2时分别向甲、乙中加入等质量的氮气后,下图中能表示甲中反应速率变化情况的是 ,能表示乙中反应速率变化情况的是 。
22.(9分)
化学几乎渗透于所有的行业,在考古工作中,化学就起着不可替代的作用。
(1)古画颜料中的铅白[Pb2(OH)2CO3]由于受空气中硫化氢气体的作用而变成溶解度极小的黑色硫化铅(反应I),影响画面的色泽,当用H2O2处理后,。可使硫化铅变成白色的物质(PbSO4)(反应II)。据此回答下列问题:
① 铅白的物质类型是 。
② 反应I的化学方程式为 。
③反应Ⅱ的化学反应方程式为 。
(2)古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重(电化腐蚀)。原因是一种叫做硫酸盐还厚蓖的细菌,能提供正极反应的催化剂,可将土壤中的SO42-还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。
① 写出该电化腐蚀的正极反应的电极反应式: 。
② 文物出土前,铁器表面的腐蚀产物可能有(写化学式) 。
21.(8分)
从含银、铜、金和铂的金属废料中提取金、金、银、铂的一种工艺如下:
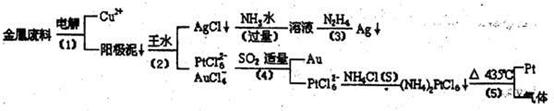
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSo4溶液为电解液,写出电解反应的最极议程式:
(2)写出步骤(4)的离子反应方程式:
(3)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)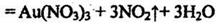 但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
(4)我们知道,稀盐酸与铜不反应。在稀盐酸中加入H2O2等氧化剂后,则可使铜顺利溶解。某同学未加入氧化剂,而是设计了一个实验装置,也能使铜溶于稀盐酸。请在方格中画出该装置:
20.(17分)
粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10一9 |
9.1×10一6 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
[设计除杂过程]
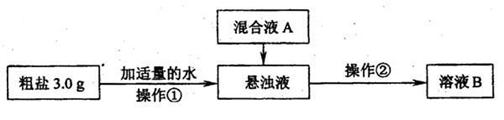
(1)操作①中需要使用的玻璃仪器有(i) 、(ii) 。操作②的名称为(iv) ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是(iv) ;
(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中。进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),如果没有沉淀生成,则Mg2+已除尽。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,如果没有沉淀生成,则Ca2+已除尽,效果最好的是 (填字母)。
A.Na2 CO3 B.Na2SO4 C.NaOH
[获取纯净食盐]
(4)对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。用试纸测pH值的实验操作为 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
[问题讨论]
(6)进行操作②前,需先加热,其目的是
,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶解B中Mg2+物质的量浓度为 。
19.(7分)
已知反应:BrO3一+5Br一+6H+=3Br2+3H2O,某探究学习小组利用该反应对化学反应速率与反应物浓度的关系进行探究,在20℃进行实验,得到的数据如下表:
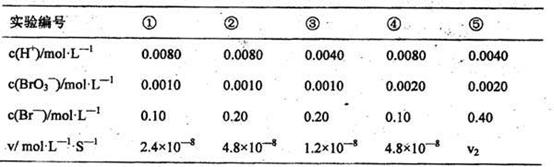
回答下列问题:
(1)反应速率V2=
(2)温度对该反应的反应速率的影响符合-般规律,若在40℃下进行编号①对应浓度的实验,反应速率v (填字母)。
A.<4.8×1一8 mol L一1·s一1
B.2.4×1一8~4.8×10一8 mol ·L一1s一1
C.>4.8×1一8mol L一1·s 一8
D.数据不足,无法判断
(3)通过分析比较上表数据,得到的结论是 。
18.室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应,下列关于
反应后溶液pH的判断,正确的是
A.若x<y,且a+b=14,则pH>7 B.若10x=y,且a+b=15,则pH=7
C.若ax=by,且a+b=13,则pH<7 D.若x=10y,且a+b=14,则pH<7
第Ⅱ卷(共87分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com