
题目列表(包括答案和解析)
1. 生活中常用到一些化学知识,下列分析中正确的是
A.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
C.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.误食重金属盐会中毒,是因为重金属盐能使蛋白质盐析
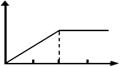
25.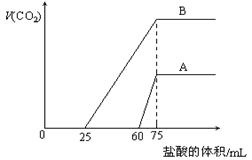 (共8分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
(共8分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是什么?其物质的量之比为多少?
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
24.(共9分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:

(1)E和N2是等电子体(原子数相同、电子数均相同、结构相似),请写出可能E的电子式: 。
(2)若G是一种淡黄色固体单质,在通常情况下16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: 。
(3)若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;请说明H的水溶液止血的原理 。
将过量F通入NaOH得到的溶液再与H溶液反应的离子方程式为 。
(4)在101kPa和150℃时,可逆反应E(g) + B(g) F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
。
A.升高温度 B.增大压强 C.加入催化剂 D.将B、E的浓度均增加1倍
23.(共10分)化学式为C11H12O4的芳香族化合物A、B互为同分异构体,A和D都能发生银镜反应,E的一溴取代物只有两种,  A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
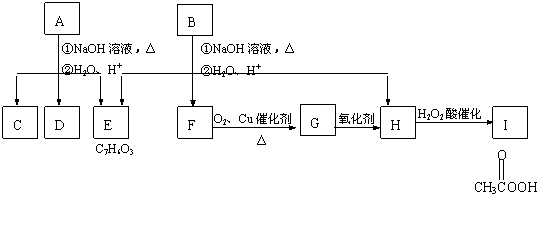
(1)A有2种可能结构,写出其结构简式 。
(2)在B、C、D、F、G、I化合物中,互为同系物的是 。
(3)写出D与F在加热和浓H2SO4催化作用下发生反应的化学方程式
,指出反应类型 。
(4)除银镜反应外至少选用其它两种实验方法证明D具有还原性,请按要求填写下表:
|
|
所选试剂 |
观察到的实验现象 |
|
方法1 |
|
|
|
方法2 |
|
|
22.(共8分)近期“问题奶粉”引起了人们的极大关注。 其问题主要是奶粉中掺杂了三聚氰胺,三聚氰胺性状为纯白色晶体,无味,密度1.573克/厘米3 (16℃)。常压下熔点为354℃(分解),快速加热升华,升华温度为300℃;微溶于冷水,易溶于热水、醚、苯和四氯化碳,可溶于甲醇、乙酸、热乙二醇等。
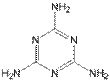 (1)三聚氰胺的结构简式如右图所示的环状物,则三聚氰胺的分子式为_________该物
(1)三聚氰胺的结构简式如右图所示的环状物,则三聚氰胺的分子式为_________该物
质的含氮量为 ,三聚氰胺为三个氰胺分子加聚而成,已知氰胺分子中除H原子
外,C、N 原子的最外层均达8个电子的结构,则氰胺的电子式为_______________,
三聚氰胺和相对分子质量相近的硝基苯比较 (无色或微黄色具苦杏仁味的油状液体。相对分子质量为123.11;熔点5.7℃。沸点210.9℃)。三聚氰胺的熔点特殊的高,
其原因是_______________________________________________________。
(2)下列关于三聚氰胺的说法中,正确的有________________(填序号,多选扣分);
A. 三聚氰胺是一种含氮量高的白色结晶,无味,所以掺入奶粉后不易被发现
B. 三聚氰胺分子中所有原子一定在同一个平面上
C. 三聚氰胺易溶于冷水,属于分子晶体
D. 三聚氰胺呈弱碱性,可以与酸反应
E. 采用三聚氰胺制造的食具一般都会标明“不可放进微波炉使用”
(3)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入了________g的三聚氰胺就可使奶粉“达标”(小数点后保留1位有效数字)。
21.(共6分)如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液见图。
|
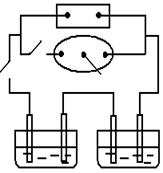 (1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴
向c端移动,则电源b端为 极,通电一段时间后,
观察到滤纸d端的电极反应式是 ;
|
 X(NO3)3,且均为0.1mol,打开K1,关闭K2,
X(NO3)3,且均为0.1mol,打开K1,关闭K2,
通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;
D装置中溶液是H2SO4,则电极C端从开始至一段时间后的实验
现象是:_____________ ___。
20.(5分)已知: NO3-+4H++3e-→NO+2H2O 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中有一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:___________________________________。
(2)反应中硝酸体现了________________ 、________________ 性质。
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:____________________________ _____________。
19.现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
|
|
读数次数 |
质量/g |
|
锥形瓶+水+试样 |
第1次 |
196.30 |
|
第2次 |
196.15 |
|
|
第3次 |
196.05 |
|
|
第4次 |
196.00 |
|
|
第5次 |
196.00 |
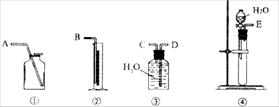
所选用装置的连接顺序应是(填各接口的字母): 。
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g、锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如右表:
计算CaC2的质量分数时,必需用到的表中数据是 。不必作第6次读数的原因是 。此试样中CaC2的质量分数为 。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
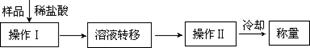
①操作Ⅱ的名称是 。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
③请指出该实验方案的至少1个不足之处 。
④请你改进找到的方案中的不足之处 。
18.相对分子质量为M的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为ω%,物质的量浓度为c mol/L,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为: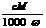 B.物质的量浓度C可表示为:
B.物质的量浓度C可表示为:
C.溶液的质量分数ω%可表示为: D.相对分子质量M可表示为:
D.相对分子质量M可表示为: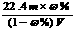
第Ⅱ卷 (非选择题,共56分)
17.把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下.)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的
A.气体Y是SO2 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com