
题目列表(包括答案和解析)
3.X、Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是 ( )
A.X的金属性比Y的金属性强
B.常温下,X和Y都不能从水中置换出氢
C.Y元素的最高价氢氧化物碱性比X元素最高价氢氧化物碱性强
D.Y元素的最高化合价比X元素的最高化合价高
2.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下转化关系(部分产物及反应条件已略去);下列判断正确的是 ( )
 A.X元素可能为Al
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
1.在物质分类中,前者包含后者的是 ( )
A.氧化物、化合物 B.化合物、电解质
C.溶液、胶体 D.非金属氧化物、酸性氧化物
5.(8分)[化学-化学与技术]海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:食盐+H2O→NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
 (4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:


上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
4.(8分)[化学-有机化学基础模块]
有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:
已知:
合成路线:

上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应② 反应④ 。
(2)写出结构简式:Y F 。
(3)写出B+E→J的化学方程式 。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式:
、 、 。
3.(8分)[化学-物质结构与性质模块]
不同元素的气态原子失去最外层第一个电子成为+1价阳离子所需要的能量称为第一电离能(E1);+1价阳离子再失去1个电子所需要的能量称为第二电离能(E2)。下表是第二周期元素及钠、钾的第一电离能数据:
|
元素 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
Na |
K |
|
E1(KJ/mol) |
520 |
900 |
801 |
1086 |
1402 |
1314 |
1681 |
2080 |
496 |
419 |
分析表中数据回答下列问题:
(1)同主族不同元素的E1变化规律是 。
(2)同周期内随核电荷数的增加,不同元素的E1值呈逐渐 的趋势,这种趋势体现了元素性质的 变化规律。引起这种变化的原因是
(3)从表中数据可判断镁元素的第一电离能数据的最小范围是:
< E1(Mg) < 。
(4)氖元素第一电离能较大的原因是 。
(5)锂和铍的第二电离能的关系为:E2(Li) E2(Be)(填>、<、=)
2.(8分)[化学-化学与技术模块]
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾溶液反应的离子方程式是
。

(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②除去杂质后的氢氧化钾溶液从液体出口_______________(填写“A”或“B”)导出。
4.(化学与技术模块)(8分)我国规定饮用水质量标准必须符合下列要求:
|
pH |
6.5-8.5 |
|
Ca2+、Mg2+总浓度 |
<0.0045mol/L |
|
细菌总数 |
<100个/mL |
以下是源水处理成自来水的工艺流程示意图:

(1)源水中含Ca2+、Mg2+、HCO32-、Cl-等,加入石灰生产Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________。
(2)凝聚剂除去悬浮固体颗粒的过程______________(填写编号)。
①只是物理过程 ②只是化学过程 ③是物理过程和化学过程
FeSO4•7H2O是常用的一种凝聚剂,它在水中最终生成________沉淀。
(3)通过二氧化碳的目的是____________________
和_____________________。
(4)气体A的作用是__________________,这种作用是基于气体A和水反应的产物具有__________性。
 5.(有机化学基础模块)(8分)某些废旧塑料可
5.(有机化学基础模块)(8分)某些废旧塑料可
采用下列方法处理:将废塑料隔绝空气加强热,
使其变成有用的物质,实验装置如图。
加热聚丙烯废塑料得到的产物如下表:
|
产 物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
|
质量分数(℅) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物 电石
电石 乙炔
乙炔 聚乙炔。
聚乙炔。
写出反应Ⅱ的化学方程式__________________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有___________种。
(3)锥形瓶C中观察到的现象___________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为______________。
(4)写出C中逸出的气体在工业上的两种用途____________、___________。
3.(物质结构与性质模块)(8分)某元素R具有微放射性,其原子核内中子数比质子数多43。R形成的固体单质A在一定条件下密度为6.68g/cm3,用X射线研究其固体表明,在边长为1.00×10-7cm的立方体中含有20个原子。R在化学反应中常表现出+2价、+4价,在溶液中R2+稳定。R与铁可形成合金,在潮湿环境中易形成铁锈。则:
(1)R原子的摩尔质量为_____________。
(2)R元素位于周期表中第_______周期______族。
(3)R3O4被大量用于油漆涂料,因而具有氧化性,有利于形成耐腐蚀的钝化层。R3O4与定量HNO3反应,产生R的氧化物、R的硝酸盐和水三种物质。此反应的化学方程式为__________。
备选: 某离子晶体的晶胞结构如图所示。求: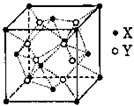
(1)晶体中每一个Y同时吸引着________个X,每个X同时吸引
着_________个Y,该晶体的化学式是_________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
________个。
(3)设该晶体的摩尔质量为Mg/mol,晶胞密度为 g/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X中心距离为________cm。
g/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X中心距离为________cm。
2.(15分)A、B两种固体都由两种元素组成。高温煅烧A、B时,A生成X2O3和C(气体);B生成Y2O3和气体C(气体)。由C可制得D(酸)。常温下,D的浓溶液可用元素X或Y的单质制成的容器储运。A与D的稀溶液反应放出有毒气体E,得到溶液F。往F溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。B置于水中,也有有毒气体E放出,生成白色胶体沉淀。Y2O3能溶解于氢氧化钠溶液中。请根据以上信息填写下列空白:
(1)A、B的化学式分别是_____________、_____________。
(2)A煅烧生成X2O3和C的化学方程式_____________________________。
(3)Y2O3能溶解于氢氧化钠溶液中,反应的离子方程式________________________。
(4)B与水发生____________反应,反应的化学方程式为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com