
题目列表(包括答案和解析)
23.(13分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)



试回答:
(1)若X是强氧化性单质,则A不可能是_________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀.则B的化学式为________________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)______________________________________
。
检验此C溶液中金属元素价态的操作方法是_________________________________
。
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______________________,X的化学式可能为(写出不同类物质)__________ 或_______________ ,反应①的离子方程式为______________________ ,或_______________________________________________________ 。
22.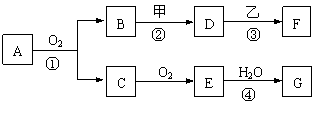 (8分)物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
(8分)物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
(1)①反应的化学方程式是__________ _______。
(2)②③两步反应的离子方程式分别是_____ ,
。
(3)在④的反应中,每1molE参加反应,将会有 mol电子发生转移。
21.(7分)有X、Y、Z、W四种短周期元素,已知:
①Z+与W的气态氢化物分子具有相同的电子数;X2-、Y-与Y的气态氢化物分子具有相同的电子数;
②X单质在空气中燃烧产生气体R;
③Y的气态氢化物与W的气态氢化物相遇时有白烟生成。
请回答:
(1)画出X2-的原子结构示意图 。
(2)Z的单质在空气中燃烧产物的化学式为: 。
(3)实验室制取W的气态氢化物的反应方程式为:
。
(4)向Y单质的水溶液中通入过量气体R的现象为:
;
反应的离子方程式为 。
20.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: NO3-+4H++3e-→NO↑+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式 。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是
。
19.(10分)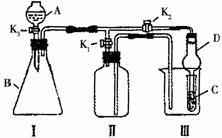 某兴趣小组同学共同设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。请回答下列问题:
某兴趣小组同学共同设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。请回答下列问题:
(1)利用装置I制取某些气体,制取气体的反
应所具有的特点是_____________________;
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。
甲同学认为:利用装置Ⅱ可以收集H2、NH3等气
体,但不能收集O2和NO,理由是
。
乙同学认为:利用装置Ⅱ作简易改进(不改变仪器装置),可收集NO、O2,改进的方法是__________________ 。
丙学认为:利用装置Ⅱ作简易改进(改变仪器装置),可收集NO2气体,改进的方法是_______________________ 。
(3)利用装置I、Ⅲ 验证物质的性质(K2打开,K1关闭)。
如设计实验证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加________ __,C中加______________ ,观察到C中的现象是___________________ 。
18.(8分)饱和氯水与石灰石的反应是制取较浓的HClO溶液方法之一。某同学运用这一方法,尝试制取HC1O溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验;
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生;
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份 。
第二份 。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式) 。
17.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
( )
A.60mL B.45mL C.30mL D.15mL
第Ⅱ卷(非选择题 共54分)
16.现有下列短周期元素的数据
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法中,正确的是 ( )
A.元素原子序数④小于⑦
B.②、③号元素处于同一周期
C.⑤号元素最高价氧化物的水化物酸性最强
D.⑧号元素是金属元素
15. 下列各图所示装置的气密性检查中,漏气的是 ( )
下列各图所示装置的气密性检查中,漏气的是 ( )
14.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将
赤铜矿与辉铜矿混合加热发生以下反应:
Cu2S+2Cu2O==6Cu+SO2↑,关于该反应的说法中,正确的是 ( )
A.该反应的氧化剂只有Cu2O B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物又是还原产物 D.每生成19.2gCu,反应中转移1.8mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com