
题目列表(包括答案和解析)
8、近年来科学家发现铝的超原子结构Al13和Al14,Al13和Al14的性质与元素周期表中某些主族元素的性质相似,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定的Al13-、Al142+。下列说法中错误的是
A.Al13与Al14互为同素异形体
B.Al13超原子中Al原子间是通过离子键结合的
C.Al14与盐酸反应的化学方程式可表示为:Al14+2HCl=Al14Cl2+H2↑
D.Al13在一定条件下能和镁作用生成Mg(Al13)2
7.下列各组离子在所给条件下能够大量共存的是
A.pH =0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B.水电离出的c(H+)=1×10-13mol/L的溶液中: K+、HCO3-、Cl-、S2-
C.使pH试纸显深蓝色的溶液中:Cu2+、NO3-、Fe3+ 、SO42-
D.在AlCl3溶液中:Na+、AlO2-、NO3-、SO42-
6.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成棕色NO2能溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
5、美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2→3CO2+4H2O
C.电路中每流过1 mol电子,标准状况下约有1.12 L丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O
4、0.3 mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5 kJ热量。下列判断正确的是
A.该反应是非氧化还原反应 B.在理论上可以利用该反应的原理做成燃料电池
C.该反应的热化学方程式为:B2H6+3O2=== B2O3(s)+3H2O(l);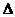 H=-2165 kJ/mol
H=-2165 kJ/mol
D.每生成18g水,该反应转移2mol电子
3. 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法不正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法不正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,铝作还原剂
D.ETFE膜(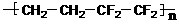 )是由两种单体加聚而成的
)是由两种单体加聚而成的
2.下列排列顺序正确的是
①热稳定性:HF>H2O>H2S ②原子半径:Cl>Na>Mg
③酸性:HClO>H2SO4>H3PO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
1、不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是
A.34S原子核内中子数为16 B.2H+的结合OH-的能力比1H+的更强
C.18O和15N原子核内的质子数相差3 D.1H216O和1H218O的相对分子质量不同
21.选做题(共计12分)本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”
两个选修课程模块的内容,每题12分。请选择其中一题作答,并把所选题且对应字母
后的方框涂黑。若两题都作答,将按A题评分。
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式 ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是
。
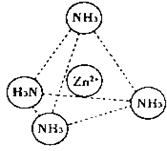
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 。
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;
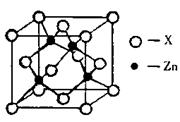
该化合物的晶体熔点比干冰高得多,原因是 。
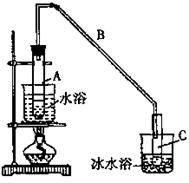
B.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇为原料制备环己烯
 已知:
已知: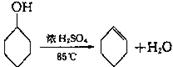

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。导管B除了导气外还具有的作用是 。
(2)制备精品
 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,分液后用
(填入编号)洗涤。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,分液后用
(填入编号)洗涤。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
②蒸馏时要加入生石灰,目的是 。
③实验制得的环己烯精品质量低于理论产量,
可能的原因是
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
(4)用溴的四氯化碳溶液可以检验环已烯,写出它们反应的化学方程式 。
20.(10分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上制备无水AlCl3的方法是:将一定粒度的铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按一定配比投入焙烧炉中加热至800℃,再将焙烧过的物料投入到氯化炉中,然后通入Cl2和O2,于950℃在石油焦还原剂的存在下,Al2O3跟Cl2反应,生成气态的AlCl3经冷却后得到氯化铝粗产品(杂质的成分是FeCl3)。尾气中含有大量CO和少量Cl2,用碱液或Na2SO4溶液除去Cl2,并回收CO。精制AlCI3粗产品一般用升华法。在升华器内,加入NaCl固体,同时加入少量某种物质X,将FeCl3杂质还原成Fe作为废渣除去,再经升华就得到精制的AlCl3。回答下列问题:
(1)氯化炉中通入O2的目的是 。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(3)用Na2SO3溶液处理尾气时发生反应的离子方程式是 。
(4)精制AlCl3粗产品时,需加入少量物质X。X可能是下列物质中的 。(填
字母)
A.FeCl2固体 B.Fe粉 C.Al粉
(5)精制无水AlCl3合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。试计算该样品中AlCl3的质量分数(写出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com