
题目列表(包括答案和解析)
18、Na2SO4溶液的溶解度曲线如右图,下列说法错误的是
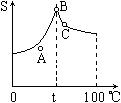 A. A点表示Na2SO4溶液尚未达到饱和,但降温或加入Na2SO4固体都可使其饱和
A. A点表示Na2SO4溶液尚未达到饱和,但降温或加入Na2SO4固体都可使其饱和
B. Na2SO4的溶解度随着温度的升高而增大
C. 在t℃时给Na2SO4饱和溶液降温或升温,都会使其溶液变浑浊
D. 制取芒硝的最佳方法是在100℃时配成Na2SO4的饱和溶液,
并降温至0℃,可析出Na2SO4·H2O晶体
17、在密闭容器中,反应X2(g)+Y2(g) 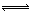 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
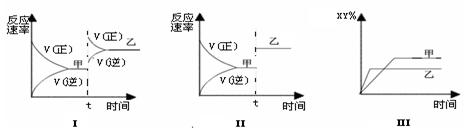
A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
16.纳米是长度单位,1纳米等于1×10-9m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是
A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快
B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快
C.常温下“纳米铜”与铜片的还原性相同
D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快。
15.为提纯下列物质(括号内为含少量的杂质),选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
碳酸氢钠(NH4Cl) |
------- |
加热 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
甲烷(C2H4) |
溴水 |
洗气 |
|
D |
苯(C6H5OH) |
浓溴水 |
分液 |
14.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是:
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y―>CO32―>X―>HCO3―
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3―)>C(X―)>c(OH―)>c(H+)
13.能正确表示下列反应的离子方程式是
A.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.向漂白粉溶液中通人SO2气体:Ca2++2C1O-+SO2 =CaSO3↓+2H C1O
C.向小苏打溶液中加入醋酸 HCO3-+ CH3COOH=CO2↑+ H2O+ CH3COO-
D.稀硝酸中加入过量铜片 3Cu +8H++2NO3-= 3Cu2++2NO↑+ 4H2O
12.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是
A.Na+、Al3+、Cl-、OH- (5:1:4:4) B.NH4+、Ba2+、OH-、Cl- (1:1:1:2)
C.Fe3+、Na+、Cl-、S2- (1:2:3:1) D.K+、H+、I-、HCO3- ( 1:1:1:1)
11、下列说法中正确的是(NA表示阿伏加德罗常数)
A.60gSiO2晶体中含有2NA个Si-O键
B.18D2O(重水)完全电解,转移2NA个电子
C.1L lmol·L-1 Na2CO3溶液中CO32-数为NA
D.14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3NA
10.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生氯气,下列关于混盐CaOCl2的有关判断不正确的是
A.该混盐的水溶液显酸性
B.该混盐具有较强的氧化性
C.该混盐中氯元素的化合价为+1和-1价
D.该混盐与盐酸反应产生1mol Cl2时转移2 mol电子
9.羟胺(NH2OH)是一种还原剂.现用25.00ml 0.049mol·L-1的羟胺的酸性溶液跟足量的Fe2(SO4)3溶液在煮沸条件下反应,生成Fe2+离子恰好与24.50ml 0.020mol·L-1的酸性KMnO4溶液完全作用生成Fe2(SO4)3、MnSO4等物质,则上述反应中羟胺的氧化产物是
A.N2 B. N2O C.NO D.NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com