
题目列表(包括答案和解析)
18.(14分)正确书写电极反应和化学方程式:
(1)铁在潮湿的空气中转变为铁锈
负极:
正极:
总反应:
氧化反应:
分解反应:
(2)正确书写离子方程式
向FeBr2 溶液中加入少量Cl2
向FeBr2 溶液中加入足量Cl2
17.(6分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、
H2O。已知水是反应产物之一。
(1)该反应中还原剂是 ;
(2)该反应中还原产物是 ;
(3)若反应过程中转移了0.3mol电子,则生成水的质量是 g。
16.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应的化学方程式如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,下列关于该反应的说法正确的是( )
A.CuSO4发生了氧化反应
B.生成1 mol H3PO4时,有10 mol电子转移
C.氧化产物和还原产物的物质的量之比为6∶5
D.白磷只作还原剂
15.氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是 ( )
A.“另一种反应物”一定只具有氧化性
B.CuH既可做氧化剂也可做还原剂
C.2CuH+3Cl2==2CuCl2+2HCl↑(燃烧)
D.CuH+HCl==CuCl+H2↑(常温)
14.电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是 ( )
A.0.10mol/LAg+ B.0.02mol/L Zn2+
C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
13.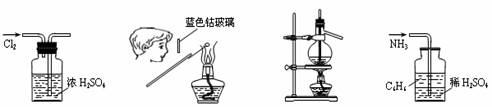 下列各图所示的实验原理、方法、装置和操作正确的是 ( )
下列各图所示的实验原理、方法、装置和操作正确的是 ( )
① ② ③ ④
A.①干燥Cl2 B.②检验K2CO3中的K+
C.③石油的蒸馏 D.④吸收NH3
12.常温下,下列溶液中一定能大量共存的离子组是 ( )
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
11.下列说法正确的是 ( )
A.不用其它试剂便无法区别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液
B.实验室常用带玻璃塞的试剂瓶保存NaOH溶液
C.用导线将电解池和电池连接,电子从电池的负极流向电解池的阳极
D.用以下反应制取硫酸铜:2Cu+O2==2CuO、CuO+H2SO4=CuSO4+H2O符合绿色化学的理念
10.下列实验可行的是 ( )
A.用澄清石灰水检验CO中含有的CO2
|
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
9.有8 gNa2O2、Na2O、Na2CO3、NaOH混合物与200g质量分数为3.65%的盐酸恰好完
全反应,蒸干溶液,最终得到的固体的质量为 ( )
A.8g B.15.5g C.11.7g D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com