
题目列表(包括答案和解析)
3、如果你家里的食用花生油混有水份,你将采用下列何种方法分离
A.过滤 B.蒸馏 C.分液 D.萃取
2、现有一瓶乙二醇和丙三醇的混合液,已知它们的性质如下表:
|
物质 |
分子式 |
熔点℃ |
沸点℃ |
密度g/cm3 |
溶解性 |
|
乙二醇 |
C2H6O2 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
|
丙三醇 |
C3H8O3 |
17.9 |
290 |
1.26 |
能与水和酒精以任意比混溶 |
据此,将乙二醇和丙三醇互相分离的最佳方法是
A.萃取法 B.分液法 C.分馏法 D.蒸发法
5.(1)用排水取气法或向下排空气取气法
(2)因废铁屑中含少量Cu等不与HCl反应的杂质,形成Fe-Cu原电池使反应速率加快
(3)稀HNO3有强氧化性,为保证使Fe2+全部氧化成Fe3+
3Fe2++4H++NO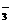 ====3Fe3++NO↑+2H2O
====3Fe3++NO↑+2H2O
(4)与大气相通,使分液漏斗中的酸可滴入A中
(5)因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O
Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O
4.(1)①a→f ,e→i, j→c, d→h, g→b
除去多余的Cl2 黑色粉末变为棕色
②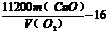 (2)ABCE (3)AC
(2)ABCE (3)AC
讲析:制得的Cl2中含有HCl、H2O,因HCl的存在对Cl2和CuO的反应产生影响,必须除去。H2O的存在对此反应无影响,要想除去得通过碱石灰,碱石灰又能吸收Cl2,故H2O不必除去。由B和E组成量气装置(应从短管口进气),在气体通入之前,需除去多余的Cl2。则装置连接顺序:制取Cl2用A,除去其中的HCl用D,发生Cl2和CuO的反应用F,除去多余的Cl2并吸水用C,量气装置由B和E组成。
3.(1)反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。
(2)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)无水硫酸铜 检验 H2O
品红溶液 检验 SO2
足量酸性 KMnO4 溶液 SO2
澄清石灰水 检验 CO2
(4) 导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成。
2.方法一:对照实验:用KCl溶液和KMnO4溶液进行比较,得出结论。
方法二:利用 MnO4- 的强氧化性。向溶液中加入还原性的物质(Na2SO3、浓HCl、FeCl2、H2O2等)
1.C 讲析:蛋壳内膜作为半透膜,鸡蛋白溶液为胶体,通过渗析可除去其中的少量食盐;电解食盐水可自制家用含次氯酸钠溶液的消毒剂;检验碘盐中是否加有碘酸钾,缺少还原剂将IO3-还原;水垢为碳酸钙和氢氧化镁的混合物,用醋酸除去。答案为C。
2.(1)2Cu+O2+2H2SO4=2CuSO4+2H2O。 (2)HNO3 (3)B、A。
新活题网站
1.(1)测定铜粉样品中铜的质量分数
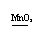 (3)
(3)
|
B、E中有气泡产生 |
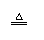 2H2O2
2H2O+O2↑ 2H2O2
2H2O+O2↑ |
|
C中的红褐色粉末变成黑色 |
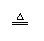 2Cu+O2 2CuO 2Cu+O2 2CuO C+O2 CO2 |
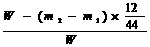
(4)
(5)偏小:水蒸汽通过C被D中碱石灰吸收; 洗气瓶 浓硫酸 (或干燥管 碱石灰)
讲析:从H2O2和MnO2可推知两者可制氧气,氧气可以氧化样品中混有的炭粉;干燥管中药品用于吸收产生的CO2,因此盛放的是碱石灰。第(5)小题出现了实验结果负误差,所以一定是D多吸收了什么物质,由此可以结合化学方程式找到水的存在,进而得到这一问题的答案。
5.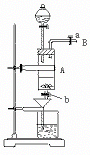 三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图3所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图3所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
(1)从B导管收集产生的气体可采用的方法是 。
(2)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。
(3)烧杯内放过量稀HNO3的原因是 ,离子方程式是 。
(4)整个实验过程中,弹簧夹a都必须打开,除了为排出产生的气体外,另一个目的是 。
(5)用降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是
。
(该题意在考查学生对化学实验装置的理解,运用学过的知识对陌生的实验装置予以解释的能力。答题时要仔细观察装置,领会仪器的所起的作用。)
答案分析:
典型题点击
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com