
题目列表(包括答案和解析)
16.(14分)2007年,美国爆发宠物食品受污染事件。事后调查表明:掺杂了≤6.6%三聚氰
胺的小麦蛋白粉是宠物食品导致中毒的原因。
2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因也是奶粉中含有三聚氰胺。
三聚氰胺是一种重要的氮杂环有机化工原料,分子式C3N6H6。动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌。
(1)三聚氰胺最早被李比希于1834年由电石(CaC2)合成。
电石与水反应生成的气体的燃烧热为Q kJ/mol,请写出该气体燃烧的热化学方程式
目前工业上较多采用尿素[CO (NH2)2]在催化剂以及380-400℃温度下发生分解反应,生成三聚氰胺及一种酸性气体和一种碱性气体。
反应的化学方程式为:
(2)由于食品和饲料工业蛋白质含量测试方法的缺陷,三聚氰胺也常被不法商人用作食品添加剂,以提升食品检测中的蛋白质含量指标,因此三聚氰胺也被人称为“蛋白精”。蛋白质主要由 缩聚而成,其含氮量平均约为20%,而三聚氰胺含氮百分量为 (保留小数点后两位)。通用的蛋白质测试方法“凯氏定氮法”是通过测出含氮量来估算蛋白质含量,因此,添加三聚氰胺会使得食品的蛋白质测试含量偏高,从而使劣质食品通过食品检验机构的测试。每100g牛奶中添加0.1克三聚氰胺,就相当于 g(保留小数点后两位)蛋白质。
(3)已知三聚氰胺分子结构对称且分子中含有3个氨基(-NH2)和类似苯环的结构,请写出它的结构简式:
(4)据你推测,下列物质能与三聚氰胺反应的是:
A.盐酸 B.氢氧化钠 C.氢气 D.三氯化铁
15.(8分)、某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。

(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
14.(12分)、科学家使用普通氧分子和带正电的氧离子作用,制出了新型的氧分子O4,它的结构复杂且不太稳定。
(1)下列有关O4的说法正确的是:
A.O4晶体是原子晶体
B.由O2合成O3或O4的反应都属于氧化还原反应
C.O4与O3、O2都是氧的同位素
D.O4能使湿润的碘化钾淀粉试纸变蓝
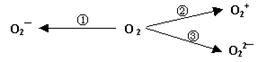 (2)制备含O2─、O22─ 甚至O2+ 的化合物都是可能的,通常它们是在
(2)制备含O2─、O22─ 甚至O2+ 的化合物都是可能的,通常它们是在
氧分子进行下列各种反应时生成的:
上述反应中, (填序号)是氧化反应,该反应中可以用 (一种单质)做氧化剂;反应错误!未找到引用源。中有16gO2参加反应时转移电子 mol。
(3)写出O22─ 的电子式:
(4)O2[PtF6]是一种含有O2+ 的化合物。请写出一种含有O2─ 的化合物的化学式: ,
推测该物质与O2[PtF6]反应的化学方程式为:
13.(16分)
(1)①向NaHCO3溶液中,逐滴加入Ca(OH)2溶液至过量,请写出发生反应的
离子方程式: 。
②在Fe(NO3)2溶液中,滴加盐酸,溶液变黄并产生无色气体,请写出反应的离子方程式:
(2)将一小块钠投入水中,观察到:钠浮于水面,说明 ;钠熔成小球,说明 ;钠四处游动并发出嘶嘶的响声,说明 ;将钠投入酒精中与投入水中所发生的现象不同点有_____________________________________ ,酒精与水相比, 更难电离。
(3)已知:酚酞在c(OH-)为1.0×10-4mol/L-2.5mol/L时呈红色,且0.5min内不会褪色; H2O2具有氧化性和漂白性。将3.9g过氧化钠放入烧杯中,加入100mLH2O,充分反应后取上述溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。
① 有人认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算并对比数据加以说明。
② 还有人认为“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶内的溶液中可能含有H2O2存在,请简述实验操作
。
③ 补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关,请简述
实验操作
12.0.64g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下224mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2 ,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.168mL B.224mL C.112mL D.56mL
11.在一密闭容器中盛有过量的NaHCO3和少量的Na2O2,将其加热到300℃经充分反应后,排出气体,容器内残留的固体是 ( )
A.NaHCO3和NaOH B.Na2CO3和NaOH
C.NaHCO3和Na2CO3 D.Na2CO3
10.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是 ( )
I2+SO2+2H2O=H2SO4+2HI 2FeCl2+Cl2=2FeCl3 2FeCl3+2HI=2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
9.下列说法中不正确的是 ( )
A.任何化学反应都伴有能量变化
|
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.需要加热才能发生的反应一定是吸热反应
8.被称为万能还原剂的NaBH4(其中H元素为-1价)溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑。下列说法中正确的是 ( )
A.NaBH4既是氧化剂又是还原剂 B.NaBO2是氧化产物
C.硼元素被氧化,氢元素被还原 D.氧化产物与还原产物的质量比为1:1
7.下列离子方程式书写正确的是 ( )
A.苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O
 B.AgNO3溶液中加入过量氨水:
B.AgNO3溶液中加入过量氨水:
C.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I- = 2Fe2++I2+3H2O
D.用石墨电极电解MgCl2溶液的离子方程式可表示为:
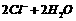 =====
=====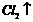
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com