
题目列表(包括答案和解析)
2.将4.8 g硫与0.2 mol 02充分反应后的气体总体积标准状况下为:
A. 1.12L B.2.24L C.3.36 L D.4.48 L
1.18世纪70年代,瑞典化学家舍勒在研究一种白色的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味,此盐是
A.NaCl B.AgCl C.AgBr D.AgI
10.(18分)利用农作物加工成的植物纤维A,有如下转化,其中B是A水解的最终产物,C的化学式为,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;H的三聚合物I也是一种六元环状化合物。(图中部分反应条件及产物没有列出)
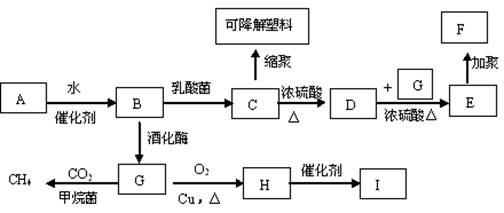
(1)写出下列物质的结构简式
高分子化合物F___________________ 六元环状化合物I___________________
(2)写出下列反应的化学方程式
A→B________________________________________________________
C→可降解塑料_________________________________________________。
(3)H分子所含官能团的名称是___________,实验室中常用于检验该官能团的试剂的名称是
(只写一种)_____________ _________。
(4)写出同时满足下列条件的C的同分异构体的结构简式
①3个氧原子分别连在3个碳原子上 ②1mol该物质与足量的钠反应生成1mol氢气
③核磁共振氢谱测得5个吸收峰
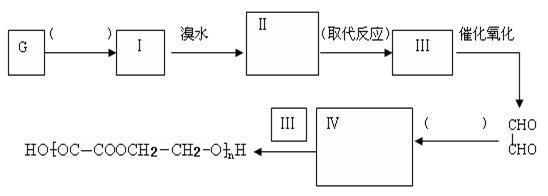
 (5)某同学设计由G合成
(5)某同学设计由G合成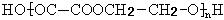 的合成路线如下:(按要求填写,( )内填写反应类型, 内填写Ⅱ和Ⅳ的结构简式)
的合成路线如下:(按要求填写,( )内填写反应类型, 内填写Ⅱ和Ⅳ的结构简式)
9.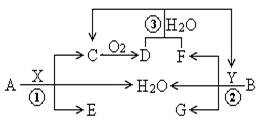 (14分)已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如下图所示,
(14分)已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如下图所示,
其中G溶液呈蓝色。
回答以下问题:
(1)E的化学式为______________,
B的化学式为_____________;
(2)E的饱和溶液加入到沸水中,溶液变为红褐色,其原因为(用离子方程式表示)
;
(3)反应①的离子方程式为 ;
(4)反应③的化学方程式为 ;
(5)写出用惰性电极电解G溶液的电解反应化学方程式
。
8.(16分)无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,
但在180℃时已开始升华。它在常温下是一种白色固体,遇水发生剧烈的水
解反应,甚至在空气中遇到微量水气也强烈地发烟。用下列装置制取无水氯化铝,
回答以下问题:
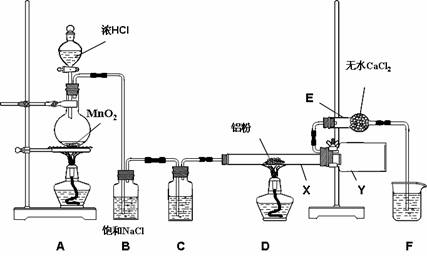
(1)装置D 中发生的化学反应方程式
(2)仪器X与仪器Y 直接相连的意图是:① 收集产物 ② ,
(3)能否去掉E 装置 ,原因是 ,
(4)实验时应先点燃 处的酒精灯,
其作用是
(5)写出铝粉与过量NaOH溶液反应的离子反应方程式
检验上述反应所得含氧酸根的方法(简述实验操作及现象)
。
7.(16分) A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H
分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式) ,
E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)
> > 。
(2)一定条件下,A的单质气体与C的单质气体充分反应生成 W气体,W的结构式
由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y, X的电子式为 ,化合物E2 D2与化合物E2H的水溶液按物质的量比1︰1反应生成单质H的离子方程式为
(3)G是非金属元素,其单质在电子工业中有重要应用,请写出G的最高价氧化物与B的单质
在高温下发生置换反应的化学反应方程式 。
(4)A的单质与D的单质在KOH的浓溶液中可以形成原电池,如果以铂为电极,则负极的
电极反应式为 。
(5) 在10 L的密闭容器中,通入2 mol的HD2气体和3 mol D的气体单质,一定条件下反应后
生成HD3气体,当反应达到平衡时,单质D的浓度为0.21 mol/L,则平衡时HD2的转化率为 ,此时该反应的平衡常数为 (用数据列关系式不必化简)
6.对于可逆反应N2(g)+3H2(g)
 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
|
|
A |
B |
C |
D |
|
研究 目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2 对反应的影响 |
催化剂对反应的影响 |
|
图示 |
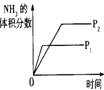 |
 |
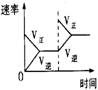 |
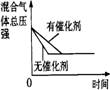 |
第Ⅱ卷 (非选择题,共64分)
5.下列各溶液中,微粒的物质的量浓度关系不正确的是
A.c(NH4 +)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:
c [(NH4)2SO4]<c [(NH4)2CO3]<c(NH4Cl)
B.0.1 mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
C.0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)= c(A2-)+c(HA-)+c(H2A)
D.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
4.用NA表示阿伏加德罗常数,下列说法错误的是
A. 25℃时1mL水中含10-10 NA个OH-离子
B.1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA
C.a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L
D.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA
3.下列实验的设计不合理的是
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用水可以一次性鉴别溴苯、苯、乙酸三种物质
C.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl
D.实验室制备乙酸乙酯时,将溶液混合后需用大火迅速加热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com