
题目列表(包括答案和解析)
31.(12分)根据下面提供的仪器和试剂,完成验证二氧化硫既有氧化性又有还原性的实验。可选用的仪器:见图(装置不可重复使用)。可选用的试剂:①盐酸;②溴水;③Na2SO3固体;④FeS固体;⑤品红溶液;⑥NaOH溶液。
试回答下列问题:
(1) 按SO2气流方向,用胶管(未画出)连接上述仪器组合成整套装置。正确连接顺序是(用数字1,2,…填入)( )→( )( )→( )( )→( )。
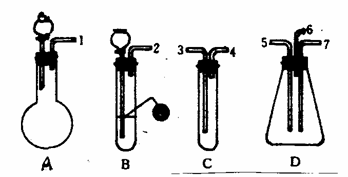
(2) 下述A-C装置中,应加入的试剂(从①、②、③、④、⑤、⑥中选取)是:


 A
B
C
A
B
C



 (3)表现SO2氧化性的实验是上述仪器中的
装置(填仪器装置代号A、B、C、D),实验过程中能观察到的实验现象是
;表现SO2还原性的实验是上述仪器中的
装置
( 填仪器装置代号A、B、C、D),实验过程中能观察到的实验现象是
。
(3)表现SO2氧化性的实验是上述仪器中的
装置(填仪器装置代号A、B、C、D),实验过程中能观察到的实验现象是
;表现SO2还原性的实验是上述仪器中的
装置
( 填仪器装置代号A、B、C、D),实验过程中能观察到的实验现象是
。
 (4)为了防止污染空气,在装置D的出气口应
。
(4)为了防止污染空气,在装置D的出气口应
。
30.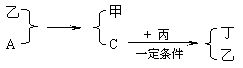 (12分)A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
(12分)A、B、C、D为中学化学中常见的四种气体单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙;C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有10个电子,并且甲、乙、丙、丁有如下关系:
试回答:
(1)丙的电子式为___________________
(2)A和乙,单质C和丙所发生反应的化学方程式分别为______________________________,_______________________________________
(3)丙和丁能否在一定条件下反应?_________(填能或不能)。
29.(10分)采用惰性电极从NO3- 、SO42- 、Cl- 、Cu2+、Ba2+、Ag+、H+中选出适当的离子组成电解质,并电解:
⑴若两极分别放出H2和O2,电解质可能为______________________________。
⑵若阴极析出金属,阳极放出O2,电解质可能为__________________________。
⑶若两极均放出气体,且体积比为1 : 1,电解质可能为______________________。
⑷若既无O2也无H2放出,则电解质可能为_________________。
28.(10分)书写下列的离子方程式:
(1)将含有等物质的量的NaHSO4和Ba(OH)2溶液混合:______________________。
(2)向碳酸氢钠溶液中加入过量澄清石灰水:______________________。
(3)用0.2 mol · L-1的H2S溶液100 mL与0.1 mol · L-1 NaOH溶液300 mL 反应:__________________。
27.(4分)抽取某地酸雨水样进行检验,测得各离子浓度分别是:C(Na+)=2.3×10-5mol/l,C(Cl-)=3.5×10-5mol/l,C(NH4+)=7.0×10-6mol/l,C(SO42-)=2.5×10-6mol/l,求该酸雨的pH值为
26.(4分)某同学从一种未知的无色溶液中检验出含Ba2+、Ag+同时溶液的酸性很强,他还准备继续检验溶液中是否含有:Cu2+、Fe3+、S2-、CO32-、AlO2-、NH4+、PO43-、Br-、K+、Al3+、SO42-、NO3-等离子,很显然,有些离子不必检验了,你认为还必须检验的离子是______________________________。
25.将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是
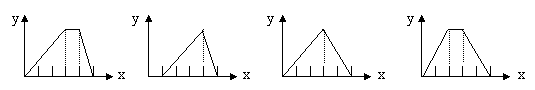
 A
B
C
D
A
B
C
D
( II卷 共60分)
24.用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL,若V3>V1>V2,则所使用仪器可能是
A、容量瓶 B、量筒 C、碱式滴定管 D、以上仪器均可
0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是
A、10mL B、5mL C、大于5mL D、小于5mL
23.已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定10mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com