
题目列表(包括答案和解析)
1、下列操作中:(1)取用药品(2)溶解(3)过滤(4)蒸发。其中要使用到玻璃棒是( )
A、(1) B、(1)、(2) C、(1)、(2)、(3)、(4) D、(2)、(3)、(4)
9.离子的检验(Cl-、 SO42- 、NH4+)方法
|
离 子 |
Cl- |
SO42- |
NH4+ |
|
检验 方法 |
|
|
|
四:练 习
8.气体的制取(氯气 氨气 乙烯 乙炔)含实验原理、实验装置、气体干燥、气体收集
|
气体 |
氯 气 |
氨 气 |
乙 烯 |
乙 炔 |
|
原料 |
|
|
|
|
|
实验 原理 |
|
|
|
|
|
实验 装置 及类型 |
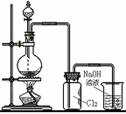 |
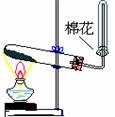 |
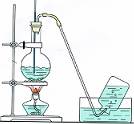 |
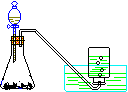 |
|
气体收集 |
|
|
|
|
|
气体检验 |
|
|
|
|
7、中和滴定 ①准备过程:检查滴定管是否漏水;用水洗涤玻璃仪器;用少量标准液或待测液润洗装标准液的滴定管或装待测液的滴定管;装液体(在锥形瓶中放一定量待测液),排气泡、调零点并记录初始读数。当然也可以用待测液滴定标准液。 ②滴定过程: 姿态:左手控制活塞或小球,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。 滴速:逐滴滴入,当接近终点时,应一滴一摇。 终点:最后一滴刚好使指示剂颜色发生明显改变时即为滴定终点。记录读数 ③数据处理及误差分析(略)
6.分液和萃取 分液是把两种互不相溶、密度也不相同的液体分离开的方法。萃取是利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法。
5.蒸馏 蒸馏是提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种混合液体的分离,叫分馏。
4.蒸发和结晶 蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅。当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离NaCl和KNO3混合物。
3.过滤 过滤是除去溶液里混有不溶于溶剂的杂质的方法。
过滤时应注意:
①一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。
②二低:滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘。
③三靠:向漏斗中倾倒液体时,烧杯的夹嘴应与玻璃棒接触;玻璃棒的底端应和过滤器有三层滤纸处轻轻接触;漏斗颈的末端应与接受器的内壁相接触,例如用过滤法除去粗食盐中少量的泥沙。
2、溶液的配制(配制一定物质的量浓度的溶液)
计算:算出固体溶质的质量或液体溶质的体积。
称量:用托盘天平称取固体溶质质量或用量简量取所需液体溶质的体积。
溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水,用玻璃棒搅拌溶解,冷却到室温后,用玻璃棒将溶液引流注入容量瓶里。
洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。
定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3m处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。
1、试纸的使用
试纸的种类很多。常用的有红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉碘化钾试纸等。(l)在使用试纸检验溶液的性质时,一般先把一小块试纸放在表面皿或玻璃片上,用沾有待测溶液的玻璃棒点试纸的中部,观察颜色的变化,判断溶液的性质。(2)在使用试纸检验气体的性质时,一般先用蒸馏水把试纸润湿。粘在玻璃棒的一端,用玻璃棒把试纸放到盛有待测气体的试管口(注意不要接触),观察试纸的颜色变化情况来判断气体的性质。 注意:使用pH试纸不能用蒸馏水润湿。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com