
题目列表(包括答案和解析)
3.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定错误的是
A.12.5 mL 16 mol/L浓硫酸与足量铜共热,可生成SO2的分子数约为6.02×1022
B.2.3 g 钠与O2完全反应时,转移电子数约为6.02×1022
C.非标准状况下1.7gNH3体积为2.24 L
D.16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数约为0.2×6.02×1023
2.下列叙述正确的是
A.合成氨工业采用500℃的较高温度是根据平衡移动原理得出的结论
B.光缆在信息产业中有广泛应用,制造光缆的主要材料是高纯度硅
C.绿色化学的核心思想是利用绿色植物治理环境污染
D.黑色物质也能造成“白色污染 ”
1.2008年9月25日21时10分,“神舟七号”顺利升空,并实施我国首次空间出舱活动。飞船的太阳能电池板有“飞船血液”之称,我国在砷化镓太阳能电池研究方面国际领先。下列有关说法正确的是
A.砷化镓电池属于原电池装置 B.砷有+3、+5两种价态
C.镓元素符号为Ge,金属性比铝强 D.镓属于过渡金属
24、(12分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是Na2CO3溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
取7.5mL乙溶液,向其中缓慢滴入甲溶液12.5mL,共收集到56mL(标准状况)气体。取12.5mL甲溶液,向其中缓慢滴入乙溶液7.5mL,共收集到112mL(标准状况)气体。
⑴判断:甲是 溶液,乙是 溶液;
⑵甲溶液的物质的量浓度为 mol/L,乙溶液的物质的量浓度为 mol/L
⑶将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生气体体积为VmL(标准状况下),则V的取值范围是 。
23. (10分)某工厂实验室排出的工业废水中含游离氯和强酸。氯气的物质的量浓度为0.015mol/L,氢离子的物质的量浓度为0.001mol/L,废水排出的速度为10.00mL/s。为除去废水中的游离氯,并使废水变为中性,提出如下方案:在废水排出管的前后两处,分别注入一定量的烧碱溶液和亚硫酸钠溶液。已知烧碱溶液的浓度为0.100mol/L,亚硫酸钠溶液的浓度为0.150mol/L。
问:⑴在废水排出管的前后两处,应分别注入 、 溶液,为什么?请用有关离子方程式表示 。
⑵两种溶液的流量应控制多大(mL/s)?写出计算过程。
22、(8分)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
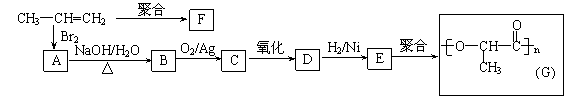
(1)丙烯分子中,最多有 个原子在同一个平面上;
(2)聚合物F的结构简式是 ;
(3)B转化为C的化学方程式是 ;
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
21.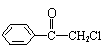 (8分)(1)苯氯乙酮是一有强催泪作用的化学试剂,它的结构简如下图:
(8分)(1)苯氯乙酮是一有强催泪作用的化学试剂,它的结构简如下图:
则苯氯乙酮不可能具有的化学性质是 (填字母序号)
A、加成反应 B、取代反应 C、消去反应 D、水解反应 E、银镜反应
 (2)今有化合物
(2)今有化合物
①请写出丙中含氧官能团的名称
②请写出与甲的另一同分异构体丁的结构简式:
③请按酸性由强至弱排列甲、乙、丙的顺序:
29、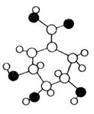 相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示。请回答下列问题:
相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示。请回答下列问题:
(1)M的分子式是 。
(2)下列关于M的说法,正确的是 。
A、遇FeCl3溶液呈紫色
B、遇紫色石蕊溶液变红色
C、遇溴水发生取代反应
 D、能缩聚为高分子化合物
D、能缩聚为高分子化合物
(3)M在一定条件下可发生反应,生成 ,该反应的化学方程式
是 。反应类型 。
(4)M与有机物A在一定条件下生成一种相对分子质量为202的酯类物质。A可能的结构简式是 。
本资料由《七彩教育网》 提供!
28、脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 。
(3)一定温度下,1mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
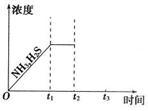 ①当反应达平衡时,P氨气×P硫化氢=a(Pa2),则容器中的
①当反应达平衡时,P氨气×P硫化氢=a(Pa2),则容器中的
总压为 Pa;
②右上图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
27、硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
提出问题:Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
实验探究:基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或 预期实验现象 |
现象解释(用离子 方程式表示) |
|
猜想② |
|
溶液pH=8 |
- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O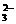 +2H+=== +2H+===S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
|
实验结果:Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
问题讨论:
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是
。
写出Na2S2O3被Cl2氧化的离子反应方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com