
题目列表(包括答案和解析)
12.B A项中应为:c(H+)十c(Na+)=c(OH-)十c(HA-)+2c(A2-)。B项中,由电荷守恒得:c(NH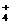 )十c(H+)=2c(SO
)十c(H+)=2c(SO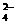 )十c(OH-),由于溶液显碱性,c(H+)<c(OH-),所以c(NH
)十c(OH-),由于溶液显碱性,c(H+)<c(OH-),所以c(NH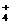 )>2c(SO
)>2c(SO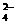 ),所以B为正确选项。C项中,由元素守恒得:
),所以B为正确选项。C项中,由元素守恒得:
c(CH3COOH)+c(CH3COO一)=0.02mol/L,所以C为错项。D项中应为:
c(NH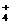 ):c(NH4HSO4)>c(NH4Cl)>c(NH4HCO3),所以D为错项。
):c(NH4HSO4)>c(NH4Cl)>c(NH4HCO3),所以D为错项。
11.B 解题时要注意技巧,本题不需要计算,因为两者完全反应生成了BaSO4沉淀和H2O,所以最后溶液中只有水,所以溶液呈中性,pH=7,所以B为正确选项。
10.B铅蓄电池的充放电反应为:Pb+PbO2+2H2SO4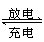
 PbSO4+2H2O,放电时Pb作负极:Pb-2e-+SO42- ===PbSO4,在正极上:PbO2+2e-+4H++SO42- ===PbSO4+2H2O;充电时,H2SO4的浓度不断增大,阳极上发生的是氧化反应,是失去电子而不是得到电子。
PbSO4+2H2O,放电时Pb作负极:Pb-2e-+SO42- ===PbSO4,在正极上:PbO2+2e-+4H++SO42- ===PbSO4+2H2O;充电时,H2SO4的浓度不断增大,阳极上发生的是氧化反应,是失去电子而不是得到电子。
9.C 依据电荷守恒得c(H+)+3c(Fe3+)+2c(Cu2+)=6mol·L-1×2,c(H+)=
c(Fe3+)=c(Cu2+),得c(H+)=c(Fe3+)=c(Cu2+)=2mol·L-1,根据
Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑,Fe+2Fe3+=3Fe2+,得m(Fe)=22.4g.
8.C 根据溶液中电荷守恒知:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),当溶液pH=7时,
c(H+)= c(OH-),那么有:c(NH4+)=2c(SO42-) ,则A错;醋酸是弱酸,不同浓
度的醋酸其电离程度不同,当pH相差一个单位时,c1>10c2 ,则B错;.pH=11的NaOH
溶液与pH=3的醋酸溶液等体积混合时,醋酸过量,溶液显酸性,滴入石蕊溶液呈红色,
C正确;向0.1 mol/L的氨水中加入少量硫酸铵固体,氨水的电离平衡向逆方向移动,
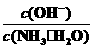 减少,则D错,故选C。
减少,则D错,故选C。
7.A 反应过程如下图所示。

由关系图可知n(Na+)=n(Cl-)=n(HCl)=40 mL×10-3L·mL-1×1 mol·L-1=0.04 mol。
所以m(Na)=23 g·mol-1×0.04 mol=0.92 g。
6.AC 银器在空气中久置会被O2所氧化变黑,为化学腐蚀,A正确。当镀层破损时,Sn-Fe
可形成原电池,不再起到保护作用,B错。与Zn块形成原电池,Zn作负极(阳极),从
而保护Fe正极(阴极),所以C正确;外加电流保护法应该与直流电源的负极相连,故
D错。
5.D NaOH与CH3COOH恰好完全反应生成CH3COONa,CH3COONa为强酸弱碱盐,水
解后溶液呈碱性,为了减少滴定误差,应选择指示剂的pH范围与CH3COONa溶液Ph
接进,所以指示剂选择酚酞。
4.D A项中水电离出来的c(H+)=c(OH-),呈中性,所以A为错项。醋酸为弱电解质,
稀释时促进其电离,所以稀释至10倍后PH<4,所以B为错项。C项中碳酸的酸性比盐酸弱,所以氯化钙溶液中通二氧化碳气体时不能发生反应,所以C为错项。D项中,如水中
加入钠,会产生氢气,减小H+的浓度,促进水的电离,所以D为正确选项。
3.D A中c(H+)=0.1mol/L,溶液显酸性,I-会被HNO3氧化,故不能大量共存;B中溶液显酸性,S2-、、CO32-不能大量共存;C中溶液可能显酸性,也可能显碱性,当溶液显碱性时NH4+、Fe2+不能大量共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com