
题目列表(包括答案和解析)
1. 2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是 ( )
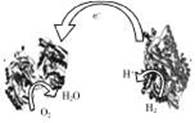 A.左边为该电池的负极
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
21.(1)0.012mol。
(2)3.8。
(3)n(OH-)∶n(CO32-)=16∶1。
(4)Al2Mg6(OH)16CO3·4H2O。
解析:(1)2片小苏打所含NaHCO3的质量为1g,其物质的量为=0.012mol,
由HCO3-+H+===CO2↑+H2O,可知n(H+)=0.012mol。
(2)6片小苏打的物质的量为:=0036mol,即中和的H+为0.036mol,而每片的Al(OH)3的物质的量为=0.0031mol,由Al(OH)3+3H+ ===Al3++3H2O,所以Al(OH)3的片数为:=3.8片。
(3)①碱式盐中加入HCl,首先是碱式盐中的OH-和CO32-与H+反应生成H2O和
HCO3-,所以n(HCO3-)=2.0mol·L-1×0.0025L=0.005mol,即n(CO32-)=0.005mol,H+与CO32-与HCl反应的H+的总物质的量为:2.0mol·L-1×0.0425L=0.085mol,所以n(OH-)=0.08mol,它们的物质的量之比为:16∶1。
②能与过量的NaOH溶液反应产生沉淀的只有Mg2+,所以n[Mg(OH)2]==0.03mol,若碱式盐中不含结晶水,则氢元素的质量分数为:0.08mol×1g/mol=0.08g,氢元素的质量分数为:=0.027<0.04,说明碱式盐中含有结晶水,根据题意有:m
(Al)+m(H2O)+0.03mol×24g/mol+0.005mol×60g/mol+0.08mol×17g/mol=3.01g,
=0.04,所以m(H2O)=0.36g,n(H2O)=002mol,m(Al)=0.27g,n(Al)=001mol,所以n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO32-)∶n(H2O)=0.01mol∶0.03mol∶0.08mol∶0.005mol∶0.02mol=2∶6∶16∶1∶4,即碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O。
20.(1)2Fe3++Cu=2Fe2++Cu2+
(2)装置图

正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO节溶液的pH至3.2-4.7;③过滤[除去Fe(OH)3]
(4)CuO+H2SO4==CuSO4+H2O ;CuSO4+Fe=FeSO4+Cu
不锈钢表面有红色物质生成
解析:把Cu与FeCl3溶液反应设计为原电池,Cu作负极、惰性电极石墨作正极,FeCl3溶液为电解质溶液。除去含Cu2+的溶液中的Fe3+、Fe2+,先把Fe2+氧化为Fe3+,由表中条件可加CuO调pH 3.2-4.7,使Fe3+转化为Fe(OH)3沉淀而除去。由不锈钢在酸中不易被腐蚀,在某些盐中易被腐蚀,取少量CuO,加入适量H2SO4制成CuSO4溶液,取不锈钢放入CuSO4溶液,若不锈钢表面有红色物质出现,证明易被盐溶液腐蚀。
19.(1)MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑
MgCl2·6H2O MgO+2HCl↑+5H2O↑
MgO+2HCl↑+5H2O↑
或Mg(OH)Cl MgO+HCl↑
MgO+HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水汽,故能得到无水MgCl2。
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤。
(3)搅拌,加速溶解
使待滤液沿玻璃棒流入漏斗,防止外洒。
搅拌,防止因局部过热液滴或晶体飞溅。
解析:(1)MgCl2·6H2O在空气中加热脱水过程中,MgCl2要水解,生成的HCl气体逸出,使平衡向水解方向移动。不利于得到纯净的MgCl2,若在干燥的HCl气流中使MgCl2·6H2O晶体脱水,HCl气体抑制了MgCl2的水解,加热过程中减少的是水分,最后可得到较纯净的无水MgCl2。
(2)由于Mg(OH)2难溶于水,Ca(OH)2微溶于水,故要除去Mg(OH)2中混有的Ca(OH)2,需加入试剂,使Ca(OH)2转化为易溶于水的钙盐,而不引入新的杂质:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,然后经搅拌、过滤、洗涤即可达到实验目的。
(3)溶解,蒸发时,用玻璃棒搅拌,而过滤时用玻璃棒引流。
18.(1)A:Al2O3 B:O2 E:NaAlO2 K:Fe(OH)3
(2)铝热剂
(3)

⑤Al3++3AlO2-+6H2O=Al(OH)3↓
⑨4Fe(OH)2+O2+2H2O=4Fe(OH)3
解析:关键是寻找突破点, D为红棕色粉末即为Fe2O3;C与Fe2O3反应得A既能与NaOH反应又能与HCl反应,则A很可能为Al2O3,C为Al,如此,一切问题迎刃而解。
17.(1)NaOH溶液.(2)除去铝镁合金表面的氧化膜.(3)⑤①④③②;使D和C的液面相平
(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑或2Al+2OH-+2H2O=2AlO2- +3H2↑
(5)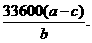 (6)偏小.
(6)偏小.
解析:(1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量。(2)由于Al表面容易生成氧化膜,因而要用酸处理。(3)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录未读数,两将相减即为产生H2的量;最后称得的固体即为Mg的质量。在读数时要注意D、C液面相平,否则气体将受压,超成读数不准。(4)B中发生的是Al与碱的反应;(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量。而n(Al)可以由产生的H2获得;(6)未洗涤,则超成(a-c)变小,则由(5)的结果得,偏小。
16.(1)接f,g接h,i接e,(h与i顺序可颠倒)(4分)
(2)吸收CO2,以便于用燃烧法除去尾气CO(2分)(答案合理给分)
(3)将点燃的酒精灯放在d处。(3分)
(4) ×100%(4分)
×100%(4分)
解析:甲装置为CO的制取装置,乙装置为CO的净化装置,除去杂质气体CO2,丁装置 为CO的干燥装置,除去水,得到干燥的CO,戊装置为氧化铁的还原装置,丙装置为尾气处理装置,其作用是吸收CO2,以便于用燃烧法除去尾气CO。
15.D 根据图像,M OH为弱碱,ROH为强碱,C中pH和为14的醋酸和ROH溶液等体积混合,所得溶液呈酸性.
第Ⅱ卷(55分)
14.C A中酸过量,应c1>c2,B中刚好完全反应形成强碱弱酸盐,c(Na+)>c(CH3COO-);因为pH=7,所以c(H+)=c(OH-),根据电荷守恒:
c(H+)+c(Na+)=c(OH-)+c(CH3COO-)知c(Na+)=c(CH3COO-)。
13.A 此题关键应注意题中“酸性”两个字,选项B溶液NaOH与CH3COOH恰好完全反应,所以溶液呈碱性;选项C中当加入NaOH后溶液仍然呈酸性,则c(H+)>c(OH-),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(CH3COO-),当碱过量时,必定c(Na+)>C(CH3COO-),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c(CH3COO-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(CH3COO-)>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(CH3COO-)=c(NH4+)+c(Na+);当溶液呈碱性时,c(H+)<c(OH-),则c(CH3COO-)<c(NH4+)+c(Na+),所以c(CH3COO-)不一定大于c(Na+)、c(NH4+)之和。故选A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com