
题目列表(包括答案和解析)
18.(10分)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1) 科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
|
晶体 |
NaCl |
KCl |
CaO |
|
晶格能/(kJ·mol-1) |
786 |
715 |
3 401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
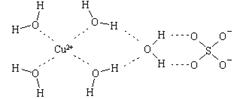
①写出基态Cu原子的核外电子排布式 ;金属铜采用下列 (填字母代号)堆积方式。




A B C D
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) 。
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响 。
17.(10分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
 Ⅰ.二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是
。
Ⅰ.二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是
。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ.2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学
家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应
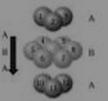
(CMR效应)研究方面的成就。某钙钛型复合氧化物(如
右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或
Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
(1)用A、B、O表示这类特殊晶体的化学式: 。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
(3)Mn的核外电子排布式为: 。
 (4)下列有关说法正确的是
。
(4)下列有关说法正确的是
。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59 ,Cr的电负性为1.66,说
明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如右图:
16.(6分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 (1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
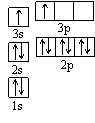
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
 ①已知金刚石中的C-C的键长为154.45pm,C60中C-C
①已知金刚石中的C-C的键长为154.45pm,C60中C-C
键长为145~140pm,有同学据此认为C60的熔点高于金刚
石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,
其晶胞如图所示,该物质在低温时是一种超导体。该物质
的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
15.硫化羰(COS)存在于许多种植物中(例如谷物),它对环境和臭氧层友好,并且杀虫效果显著。它与CO2、CS2互为等电子体,已知C=O键能为745kJ/mol,,有关硫化羰的结构说法正确的是 ( )
A.分子中有2个 键和1个
键和1个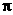 键
键
B.可推测C=S键能大于542kJ/mol
C.COS中碳原子采用的是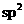 杂化方式成键的
杂化方式成键的
D.分解温度CS2、COS、CO2依次由低到高
第Ⅱ卷(非选择题 共55分)
14.X、Y、Z三种元素价电子排布分别为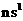 、
、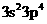 、
、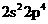 ,有关这三种元素的说法不正确的是 ( )
,有关这三种元素的说法不正确的是 ( )
A.Y元素可显+6价
B.X、Y、Z三种元素组成的化合物化学式可能是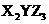 、
、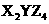 等
等
C.X、Y、Z三种元素组成的化合物不一定呈中性
D.Y的电负性比Z大
13.下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
 ②在晶体中只要有阳离子就一定有阴离子
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
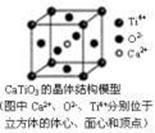
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
11.下列化学用语表达正确的是 ( )
 A.氟原子基态时电子排布式:
A.氟原子基态时电子排布式: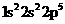
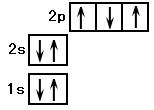
B.右图为氮原子基态时的轨道表示式:
C.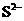 电子排布式:
电子排布式: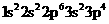
D. 原子基态排布式:
原子基态排布式: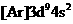
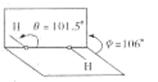 12.我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如图所示, ( )
12.我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如图所示, ( )
结合以上信息,下列说法不正确的是 ( )
A.H2NCONH2与H2O2是通过氢键结合的
B.H2O2是极性分子,其结构简式为
C.H2O2既有氧化性又有还原性
D.任何分子式中的“· ”都表示氢键
10.已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是 ( )
A.HClO3 B.H2SeO3 C.H3 BO3 D.HMnO4
9.已知NH3、H2S等分子是极性分子,CO2、BF3、CCl4等分子是由极性键构成的非极性分子,据以上事实,可推出ABn型分子是非极性分子的经验规律 ( )
A.分子中不能含有氢原子
B.在ABn型分子中A的相对原子质量应小于B的相对原子质量
C.在ABn型分子中A原子最外层没有孤对电子,即价电子全部成键
D.分子中每个共价键的键长应相等
8.三氟化硼是平面正三角形,因此是非极性分子,推断三氯甲烷(碳原子位于分子结构中心)的结构和分子的极性情况是 ( )
A.正四面体,非极性分子
B.平面三角形,非极性分子
C.四面体,极性分子
D.平面三角形,极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com