
题目列表(包括答案和解析)
20.(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.生高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
19.(8分)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的是化合物G。
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:
①化合物G的化学式为 。
②1mol NH3 和0.75molE恰好完全反应生成G和HCl,则化合物E的分子式为 。
(2)粉末状G能够与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃、水泥、陶瓷的主要原料。与氧反应所得的产物还有一种单质,与水反应生成另一种产物是该种单质元素的氢化物。请写出化合物G与水反应的化学方程式 ;
(3)用金属制造的发动机,燃料的有效利用率只有28%-38%,用G制作的发动机可将热效率提高到50%,简述其原因 。
(4)关于化合物G的说法正确的是 (填序号)。
A.化合物G中硅元素显-4价,另一种元素显+3价
B.化合物G 中每个原子都达到了8电子结构,硅原子与另一元素的四个原子相连
C.化合物G为共价化合物
D.化学物G 具有超强的硬度
17.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
(1)反应③的化学方程式________________。
(2)C的结构式________;H的化学式________________。
(3)L的溶液与化合物E反应的离子方程式________________。
(4)化合物J的化学式________________。
 18.(8分)甲、乙为单质,丙为氧化物,它们存在如下关系:
18.(8分)甲、乙为单质,丙为氧化物,它们存在如下关系:
(1)若甲、乙均为非金属,满足条件的甲、乙可能是______、
______。(列举常见的两组)
(2)若甲为金属,乙为非金属,甲、丙反应的化学方程式可能
为:________________。
(3)若甲、乙均为金属,甲、丙反应的化学方程式为:______________________________。
16.(9分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅。
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl========SiHCl3+H2
③SiHCl3与过量H2在1000-1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为______________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
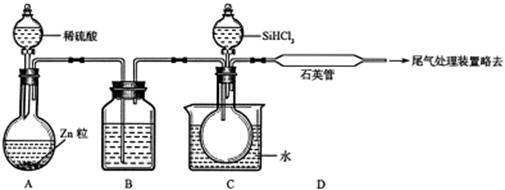
②反应一段时间后,装置D中观察到的现象是______________________________,装置D不能采用普通玻璃管的原因是________________________________________,装置D发生反应的化学方程式为________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入试剂(填写字母代号)是__________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
15.1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.504mL B.168mL C.336mL D.224mL
第Ⅱ卷(55分)
14.铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现有2mol/L,稀硫酸30mL,往其中加入1.7gNaNO3晶体,充分溶解,该混和液最多可溶解铜的物质的量为
( )
A.0.045mol B.0.03mol C.0.0225mol D.0mol
12.反应L(s)+aG(g)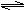 bR(g)达到平衡时,温度和压强对该反应的影响如图所示。图中压强P1>P2,x轴表示温度,y轴表示平衡混合气体G的体积分数。据此可判断 ( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示。图中压强P1>P2,x轴表示温度,y轴表示平衡混合气体G的体积分数。据此可判断 ( )
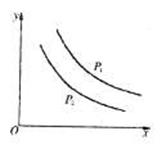
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.无法判断a、b的相对大小
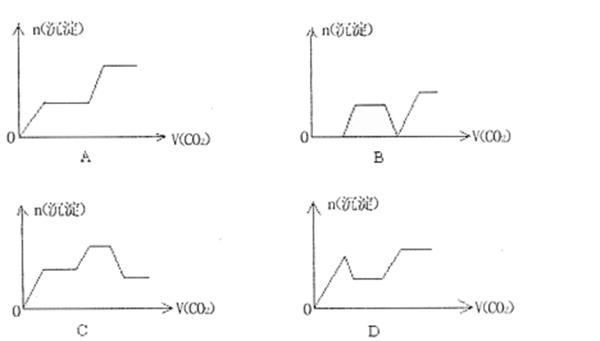 13.将足量的CO2不断通入KOH、Ba(OH)2、KA1O2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
13.将足量的CO2不断通入KOH、Ba(OH)2、KA1O2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
11.下图为含有同一种元素的a、b、c、d、e五种物质的转化关系。其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是①C②N2③S④F2中的 ( )

A.只有①和③ B.只有④ C.①②③ D.①②③④
10.有关下列各装置图的叙述,不正确的是 ( )
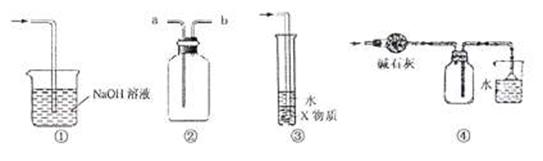
A.装置①可用于吸收实验中多余的C12
B.装置②可用于收集H2、NH3、C12、HC1、NO2等
|
D.装置④可用于收集氨气,并吸收多余的氨气
9.下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
 ( )
( )
编号 气体 a b c
A. NH3 浓氨水 生石灰 碱石灰
B. CO2 盐酸 碳酸钙 饱和NaHCO3
C. NO 稀HNO3 铜屑 H2O
D. NO2 浓HNO3 铜屑 NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com