
题目列表(包括答案和解析)
18.(1)C、Si C、H2
(2)2Na+2H2O=2NaOH+H2↑或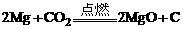 或
或
 (任填一种)
(任填一种)
(3)
解析:甲、乙为单质,丙为氧化物,则所列举的反应属于置换反应。(1)若甲、乙均为非金属,则甲、乙可能是C、Si或者是C、H2;(2)若甲为金属,乙为非金属,则甲与丙反应的化学方程式可以是:2Na+2H2O=2NaOH+H2↑或 或
或 ;(3)若甲、乙均是金属,则甲、丙反应的化学方程式为:
;(3)若甲、乙均是金属,则甲、丙反应的化学方程式为: 。
。
17.(1)2NH3+H2SO4=(NH4)2SO4
(2)N≡N ; (NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-=Cl-+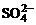 +H2O
+H2O
(4)N2H4
16.
(2)分馏(或蒸馏)
(3)①浓硫酸 使滴和烧瓶中的SiHCl3气化
②有固体物质生成 ; 在反应温度下,普通玻璃会软化 ;

③排尽装置中的空气 ④b d
解析:(1)高温用C还原SiO2生成CO而不是CO2。
(2)分离、提纯不同沸点的液体可以采用分馏或蒸馏的方法。
(3)用Zn、稀H2SO4制得的H2会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置选择液态干燥剂浓硫酸。C装置用水浴加热SiHCl3使其挥发成气体,和H2进入D装置反应。因为 的温度很高,不能使用普通玻璃管。因为SiHCl3容易在空气中自燃,实验中还要注意先通一段时间H2排尽装置中的空气。
的温度很高,不能使用普通玻璃管。因为SiHCl3容易在空气中自燃,实验中还要注意先通一段时间H2排尽装置中的空气。
0.002 n(O2)=0.01
VO2=0.01mol×22.4L/mol=0.224L为224mL
15.D 由反应过程知:Cu失去的电子被 得到,变成NO2、NO,NO2、NO又被O2氧化变为
得到,变成NO2、NO,NO2、NO又被O2氧化变为 ,据电子守恒,铜失去的电子被氧气得到变成O2-即相当于:
,据电子守恒,铜失去的电子被氧气得到变成O2-即相当于:
2Cu + O2=2CuO
2 1
14.B n(NO3-)=n(NaNO3)=0.02mol;n(H+)=2n(H2SO4)=0.12mol。由反应方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O知NO3-的量不足,以不足量进行计算,n(Cu)=0.03mol,B选项正确。
13.C CO2和溶液中OH-反应生成的 ,和Ba2+结合成BaCO3沉淀。Ba2+完全沉淀后,CO2继续和剩余的OH-反应,但不会产生沉淀。然后CO2和
,和Ba2+结合成BaCO3沉淀。Ba2+完全沉淀后,CO2继续和剩余的OH-反应,但不会产生沉淀。然后CO2和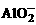 发生:
发生: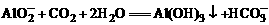 。
。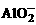 完全反应后,CO2会和碳酸钡沉淀继续反应,生成溶于水的碳酸氢钡。
完全反应后,CO2会和碳酸钡沉淀继续反应,生成溶于水的碳酸氢钡。
12.B 根据题图可知,在定压下,G的体积分数随温度的升高而减小,说明升高温度,平衡正向移动,所以正反应是吸热反应,选项B正确;在定温下,压强越大,G的体积分数越大,说明增大压强,平衡向逆反应方向移动,所以a<b,故选项C、D均错误。
11.C 此题旨在考查考生对元素化合物知识的掌握情况。碳单质及其氢化物烃均可转化成
CO、CO2及H2CO3;氮气及NH3均可转化成NO、NO2及HNO3;硫单质及H2S均可转化成SO2、SO3及H2SO4。氟单质不能形成氧化物。
10.C 此题考查了实验室中几个典型装置。C装置中所盛苯的密度比水小,应在水面之上。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com