
题目列表(包括答案和解析)
7. 下列事实或变化,能证明一水合氨是弱电解质的是( )
A. 氨水受热分解挥发出氨气
B. 氨水与醋酸反应生成醋酸铵,而醋酸铵是强电解质
C. 氨水的导电能力弱
D. 在氨水溶液中存在NH3·H2O分子
6.100ml 1mol·L-1H2SO4中加入下列物质后,导电性最差的是 ( )
A.0.2molKOH固体 B.0.1molBa(OH)2固体 C.100mlH2O D.0.1molFe
5.除去鸡蛋白胶体中混有的少量Cl-的最简单方法是 ( )
A.加入少量硝酸银溶液 B.加热 C.电泳 D.渗析
4.下列盛放物质的方法:①把汽油放在带橡皮塞的玻璃试剂中 ②把氢氧化钠溶液放在带橡皮塞的试剂瓶中 ③把硝酸放在棕色的玻璃试剂瓶中 ④把氢氟酸放在无色透明的玻璃试剂瓶中 ⑤把白磷放在水中,其中正确的是 ( )
A.①②③④⑤ B.②③⑤ C.①④ D.①②③
3.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
2.下列说法中正确的是 ( )
A.非金属氧化物一定能与碱发生反应
B.金属氧化物一定不能与碱发生反应
C.酸性氧化物一定能与水反应生成酸
D.酸性氧化物可能与酸发生反应
1.将下列各组物质按酸、碱、盐顺序排列,正确的是: ( )
A.硫酸、纯碱、石灰石 B.醋酸、酒精、醋酸钠
C.亚硫酸、熟石灰、小苏打 D.石炭酸、熟石灰、明矾
36、(6分)白色粉末A由NaNO3、Na2SO3、Na2SO4三种物质中的一种或几种混合而成。取A样品,投入100 mL 2.2 mol/L硫酸(过量)中,使它们在密闭容器中充分反应。反应后测得,反应中产生的896mL(标准状况下)纯净的无色气体不能使品红溶液褪色,该气体遇空气变为红棕色;反应后的溶液中只含有一种酸根阴离子,且其物质的量浓度为3.1 mol/L。(设反应后溶液的体积仍为100mL)
(1)反应后溶液中酸根阴离子的化学式为______________。
(2) 原A样品中含有的各物质的物质的量分别为?(要求写出简单运算过程)
35、实验室中有甲﹑乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲﹑乙两瓶溶液的成分及其物质的量浓度,现操作如下:
①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,其收集到CO2气体224mL﹙标况﹚。②量取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00mL,其收集到CO2气体112mL﹙标况﹚。 请回答: (1)根据上述两种不同操作过程及实验数据可判断甲溶液是 (填名称) (2)甲溶液的物质的量浓度为 mol﹒L-1
乙溶液的物质的量浓度为 mol﹒L-1 ﹙忽略CO2在溶液中的少量溶解﹚。 (3)若用类似上述“互滴”的方式。
①将100 mL 3mol/L的NaAlO2溶液逐滴加入50mL12mol/L的HCl溶溶液中,充分反应。
发生反应的离子方程式为_______ 。
②将50mL12mol/L的HCl溶液逐滴加入100 mL 3mol/L的NaAlO2溶液中,充分反应。
两种混合方式生成沉淀的量是否相等_______(“相等”“不相等”)
34、本题由两部分组成
Ⅰ 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
O=O |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
498 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”):?SiC_________________Si;SiCl4_____________SiO2。
 (2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g) 该反应的反应热ΔH=______________kJ·mol-1。
Si(s)+4HCl(g) 该反应的反应热ΔH=______________kJ·mol-1。
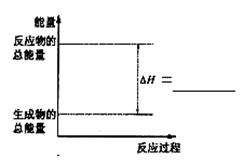
(3)请把右图表示固体Si在O2中完全燃烧生成SiO2
固体的能量变化图补充完整。
Ⅱ 某实验小组设计下列实验
A 分别配制250 mL 1.0 mol/L盐酸跟和250 mL 1.1 mol/L氢氧化钠溶液。
B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1) 为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、250mL容量瓶(2个),还缺少的仪器有____ _ _
进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有________ _____
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得
的△H (填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
温差(t2-t1) /℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
31.8 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的热化学反应方程式为____________ ______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com