
题目列表(包括答案和解析)
27. 已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是:______ (填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,则使溶液呈黄色的微粒是_________。
(2)如果要验证乙同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂: A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液
|
实验方案 |
所选用试剂(填代号) |
实验现象 |
|
方案一 |
|
|
|
方案二 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是______ ,相应的离子方程式为 ;
26.有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下:
(1)实验时,连接装置的顺序是 ;导管接口的顺序是 。
(2)装置①内发生反应的化学方程式是 。
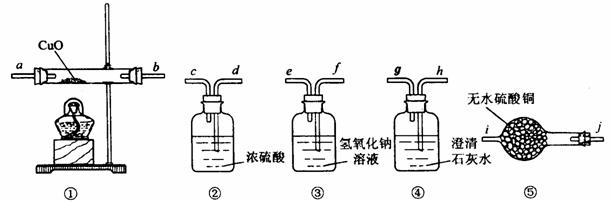 (3)证明混合气体中含有氢气的实验现象是
。(4)证明混合气体中含有CO的实验现象是
。
(3)证明混合气体中含有氢气的实验现象是
。(4)证明混合气体中含有CO的实验现象是
。
25. KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
I. 称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;
II. 用微孔玻璃漏斗(无需滤纸)过滤除去难溶的MnO(OH)2;
III. 过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
IV. 利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质,如草酸晶体H2C2O4•2H2O )溶液标定其浓度。已知: MnO4- →Mn2+ 、 H2C2O4 → CO2 反应中其他元素没有得、失电子。请回答下列问题:
(1)不用普通滤纸过滤器过滤KMnO4溶液的原因是 ;
(2)如何保证在700C-800C条件下进行滴定操作: ;
(3)准确量取一定体积(25.00 mL)的KMnO4溶液使用的仪器是 ;
(4)若准确称取W g基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。问:
①滴定终点标志是 ;
②KMnO4溶液的物质的量浓度为 mol·L-1;
(5)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 (填“偏高”或“偏低”)
24.下列实验操作中,正确的是
①称量固体药品时,将药品直接放在天平托盘上。
②实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
③先将pH试纸用蒸馏水润湿后,再测定溶液的pH
④在量筒中稀释浓硫酸
⑤金属锂保存在煤油中
⑥金属钠不慎燃烧立即用沙子覆盖
⑦用100mL量筒量取2.50mL盐酸
23.对下列仪器回答问题:
①容量瓶 ②蒸馏烧瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥蒸发皿 ⑦分液漏斗⑧玻璃棒
(1)使用时必须检查是否漏水的有 (填序号)
(2) 某学生要提纯混有泥沙的食盐,他设计的主要操作有:溶解、过滤、蒸发。在这些操作中都需要使用的仪器是 (填序号)
22.20℃时碳酸钠、碳酸氢钠的溶解度分别为:21.2g 、9.6g 。现有20℃时的碳酸钠饱和溶液60.6g,向其中通入二氧化碳气体,刚好完全反应。设反应前、后溶液温度不发生变化,溶液密度均近似为1g/cm3,则反应后所得溶液的物质的量浓度约为: ( )
A.3mol/L B.4mol/L C.1mol/L D.无法计算
非选择题
21. 用排空气法收集一试管NO2,倒立于水槽中,足够长时间后,管中液面上升到距管底二分之一处,则原混合气体与氢气的相对密度之比约为(设空气的平均分子之量为29) ( )
A. 2:1 B. 12:1 C. 21:1 D. 23:1
20. 两烧杯中分别盛有等量且足量的盐酸,现分别加入0.1molBaO和另一种物质X,最终两烧杯中物质的总质量相同,则X可能是 ( )
A. 0.1mol Ba B. 0.1mol Ba(OH)2 C. 0.1mol BaSO4 D. 0.1molBaCO3
19.地面上空少量的臭氧可以使空气清新,但臭氧含量过高又对人体有害。一些消毒柜中安有臭氧发生器,将10L空气通过臭氧发生器,有部分氧气发生反应:3O2 2O3,得到9.7L混合气体,其中臭氧的体积(相同条件下)是
( )
2O3,得到9.7L混合气体,其中臭氧的体积(相同条件下)是
( )
A.0.6L B.0.5L C.0.3L D.1 L
18.现有三种常见治疗胃病药品的标签:

① ② ③
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是:
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com