
题目列表(包括答案和解析)
9. (17分)I、糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是 (填字母序号)。
A. 葡萄糖属于碳水化合物,分子可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B. 糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C. 葡萄糖可用于制镜工业
D. 淀粉水解的最终产物是葡萄糖
(2)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物A。A的实验结果如下:
①通过样品的质谱测得A的相对分子质量为60。
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:乙醇(CH3CH2OH)
有三种氢原子(图1)。经测定,有机物A的核磁共振氢谱示意图如图2。

③将A溶于水,滴入石蕊试液,发现溶液变红。
试推导写出A的结构简式为 。
II、已知物质A显酸性,F为七原子组成的环状结构,请根据以下框图回答问题:

(1)A、H的结构简式为 、 。
(2)a、b的反应类型分别为 、 。
(3)D和E生成F的化学方程式 。
(4)写出C的同分异构体中属于酯类物质的结构简式 、
(任写2种)。
8. (17分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·2Cr2O3)利用以下过程来制取。
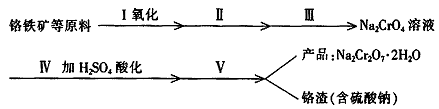
①步骤Ⅰ中反应的化学方程式为:
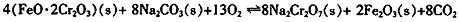
在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A. 升高温度 B. 通入过量的氧气
C. 将原料粉碎 D. 增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ是除去Na2CrO4溶液中的杂质。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按物质的量比为1:2混合溶于水后经适当操作可得到K2Cr2O7晶体。其溶解度随温度升高而升高且受温度影响大,请填写表中空格,探究制备过程。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
(3)K2Cr2O7的酸性溶液具有很强的氧化性,试写出其与FeSO4溶液反应的离子方程式:
。
7. (11分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
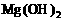 |
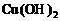 |
 |
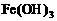 |
|
溶解度/g |
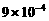 |
 |
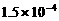 |
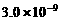 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加入足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+氧化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A. H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B. 将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C. 调升溶液pH=4可选择的试剂是氢氧化铜
D. Cu2+不能大量存在于pH=4的溶液中
E. 在pH>4的溶液中Fe3+一定不能大量存在
6. 一定温度下,有可逆反应:2A(g)+2B(g)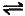 C(g)+3D(g)△H<0。现将2mol A和2mol B充入体积为V的甲容器,将2mol
C和6mol D充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
C(g)+3D(g)△H<0。现将2mol A和2mol B充入体积为V的甲容器,将2mol
C和6mol D充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
A. 甲容器中的反应先达到化学平衡状态
B. 在甲容器中再充入2mol A和2mol B,平衡向正反应方向移动,此时平衡常数增大
C. 两容器达平衡后升高相同的温度,达到新的平衡,甲、乙容器中平衡混合物中各组分的体积分数不同
D. 两容器中的反应均达平衡时,平衡混合物中各组分的体积分数相同,混合气体的平均相对分子质量也相同
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5
第Ⅱ卷(非选择题 共64分)
5. 下面是常见的电化学装置图,①③④中均为惰性电极,下列说法正确的是( )。
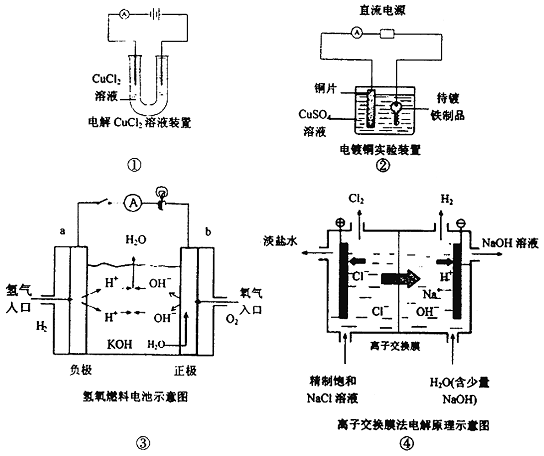
A. 装置①中阳极反应式为: ,阴极反应式为:
,阴极反应式为: ,电解完全后,溶液中的酸性增强
,电解完全后,溶液中的酸性增强
B. 装置②中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g
C. 装置③中b极为负极,该极的电极反应方程式为
D. 装置④中阳离子交换膜上每透过1mol Na+时,则阴极上产生11.2L H2
4. 我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是( )。
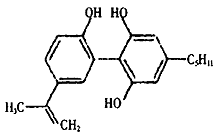
A. 滴入酸性KMnO4溶液,紫色褪去,可证明结构中存在碳碳双键
B. 1mol该物质与H2(一定条件下)反应时,最多消耗H2的物质的量为7mol
C. 该分子中所有的碳原子不可能在同一平面上
D. 该物质的分子式为C20H24O3
3. 下列各组溶液中,不用其它化学试剂,而用物质间两两混合的方法不可能鉴别出的是( )。
A. NaOH、AlCl3、盐酸、Na2CO3 B. BaCl2、AgNO3、Na2CO3、CaCl2
C. 淀粉、淀粉和KI、KI、溴水 D. NaHCO3、稀硫酸、Na2SiO3、Na2SO3
2. 下列说法不正确的是( )。
A. 向鸡蛋白溶液中滴入饱和硫酸铵溶液,不会析出白色沉淀
B. 向沸水中滴入饱和氯化铁溶液,能制取氢氧化铁胶体
C. 浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应
D. 蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物
1. 生活中碰到的某些问题,常涉及到一些化学知识,下列分析不正确的是( )。
A. Mg(OH)2和Al(OH)3受热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃性气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂
B. 用工业废弃物二氧化碳生产塑料,不会产生白色污染并有助于缓解温室效应
C. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
D. 蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质
28.(7分)现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的
量分数为x;研成粉末后,全部投入含b mol。HNO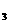 的稀溶液中,微热使其充分反应,
的稀溶液中,微热使其充分反应,
且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有cu,则溶液中含有的金属离子为____________________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe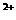 、Cu
、Cu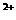 时,则b的取值范围是(用a、x表示)______________。
时,则b的取值范围是(用a、x表示)______________。
(3)当x=0.5,溶液中Fe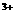 与Fe
与Fe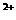 的物质的量相等时,在标准状况共产生672mL气体。
的物质的量相等时,在标准状况共产生672mL气体。
求a、b的值。(要有必要的计算过程)
唐山市2008--2009学年度高三年级第一学期期末考试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com