
题目列表(包括答案和解析)
29、2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃复分解反应研究方面所取得的成绩。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。如:
 CH2=CHR1+CH2=CHR2
CH2=CHR1+CH2=CHR2 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
 又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
②F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;I的分子式为C9H14O6
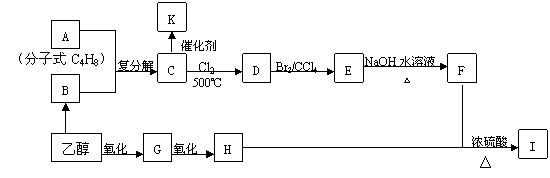

请回答下列问题:
(1)C4H8属于烯烃的同分异构体有 种;
(2)分子式为C4H8的所有烯烃通过烯烃复分解反应后生成的C5H10有 种结构。
(3)请写出I物质的结构简式I:_______________________
(4)写出反应类型:乙醇→B ;E→ F
(5)写出下列反应方程式:
C→D:
乙醇→G_________________________________________________
28、带支链的烷烃A(C6H14)只可能有三种一氯取代产物B、C和D,以上反应及B的进一步反应如下图所示。
请回答:
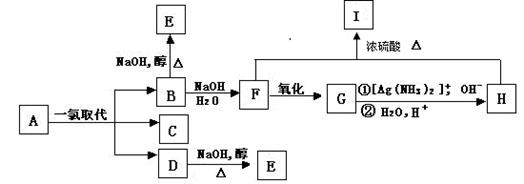
(1)A的名称是 ,I的分子式是 。
(2)写出下列反应的化学方程式:
B→F
______________________________________________________________;
D→E
______________________________________________________________。
(3)将1molA的一氯取代物的混合气体充分燃烧,生成CO2、H2O和HCl,则需氧气 ________________mol。
(4)某一有机物X是H的同分异构体,可发生下列变化:
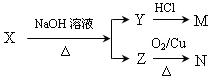
已知M为羧酸,且M、N均不发生银镜反应,则X的可能结构有_____________种;写出Z可能的结构简式:_____________________________________________
27、纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。
已知:① 在潮湿空气中CaO2能够发生反应:
CaO2+2H2O → Ca(OH)2+H2O2
2CaO2+2CO2 → 2CaCO3+O2
② CaO2与稀酸反应生成盐和H2O2:CaO2+2H+ →Ca2++H2O2
在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
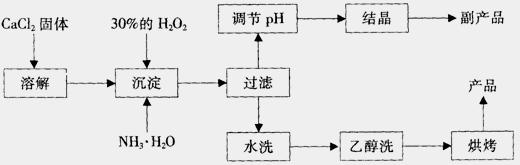 其制备过程如下:
其制备过程如下:
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 ;
(3)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。 A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol/L的Na2SO3溶液至反应完全,消耗Na2S2O3溶液V mL。
[已知:I2+2S2O32-→ 2I-+S4O62-(无色)]
①第三步中说明反应恰好完全的现象是 ;
②CaO2的质量分数为 (用字母表示);
③ 某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
26、某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。

试回答:
(1)已知6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出9.83 kJ热量。反应的热化学方程式为 ;
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是_____________________________________,A中的药品是 ;
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作_______________________________________;
(4)在实验过程中不能持续加热的理由是 ;
(5)C装置用来收集三氧化硫,其中冰盐水的作用是 ;
(6)若用a g铜跟足量浓硫酸反应制二氧化硫,实验结束时得到b g 三氧化硫,该实验中二氧化硫的转化率为________________;
(7)为了减轻实验对环境的污染,请你设计尾气处理装置,用简要文字回答:_______________________________________________________。
25、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
24、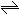 在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s-40s内用N2O4表示的平均反应速率为 mol/L.
(1)计算20s-40s内用N2O4表示的平均反应速率为 mol/L.S;
(2)计算在80℃时该反应的平衡常数K= (请注明单位);
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
(4)要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
 C.使用高效催化剂 D.升高温度
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化
曲线,请在该图中补画出该反应在60℃时
N2O4物质的量的变化曲线。
23、如果原子核外电子按1s2s2p3s3p……的能级顺序填充,s亚层有一个轨道,p亚层有三个轨道,假设每个轨道最多只能容纳一个电子,每个电子层各轨道都充满电子即为稳定结构。
(1)请你据此制作一张有前三周期的元素周期表,用A、B、C……表示元素符号填充在下表相应的空格里(A是1号元素,其余类推,已填好B、E两元素)。
|
|
|
|
|
|
B |
|
|
E |
|
|
|
|
|
(2)化学性质稳定,难以参加反应的元素是 (用A、B、C……表示)。
(3)第8号元素位于第 周期 族,其电子排布式为
,它和2号元素形成化合物的化学式为 (用A、B、C……表示)。
(4)这些元素的两个原子形成一个共价键时,两个轨道应共用 个电子。
22、某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:
b≥80y(1-a/3)
第Ⅱ卷 (非选择题,共84分)
21、25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
B.Na2CO3溶液中:2c(Na+) =c(CO32-)+c(HCO3-) +c(H2CO3)
C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:
c(Na+)>c(SO42-) >c(NH4+) >c(OH-) =c(H+)
D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
20、将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。下列叙述不正确的是( )
A.消耗铝的质量相等
B.NaOH溶液和盐酸的体积相等
C.两反应中转移的电子数相等
D.反应后两溶液混合会产生白色沉淀且溶液中的溶质只有NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com