
题目列表(包括答案和解析)
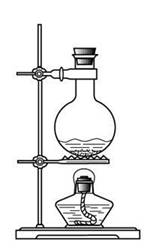
2、甲同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物。
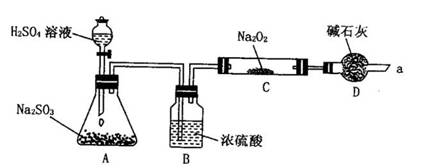
回答下列问题:
(1)装置B的作用___________________________________________________。
装置D的作用_____________________________________________________。
(2)如何检验反应中是否有O2生成______________________________________。
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:

 加Ba(NO3)2溶液
加足量稀HNO3
加Ba(NO3)2溶液
加足量稀HNO3



得出结论:产物是Na2SO4.
该方案是否合理____________(填是或否),理由是_____________________-。
(4)若上述不合理,请设计一个能确定产物成分的实验方案,填写下表(可不填满)
|
操作步骤(加入试剂) |
实验现象 |
结论 |
 1 1 |
|
 |
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
1、某化学课外小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器均未画出,“△”表示酒精灯热源),每套装置又划分为①、②、③三部分。仪器中盛放的试剂为:a、无水乙醇(沸点:78℃)b、铜丝;c、无水硫酸铜;d、新制氢氧化铜悬浊液。
(1)简述三套方案各自的优点。

甲:_____________________________________________________
乙:_____________________________________________________
丙:____________________________________________________
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流由左到右的顺序表示为______________________________________________(例如:甲①,乙②,丙③)
(3)若要保证此实验有较高的效率,还需补充的仪器有_____________;理由是_____________________________________。
17.“绿色试剂”双氧水可作为矿业废液消毒剂,如用于消除采矿业废液中的氰化物(如KCN),化学方程式为: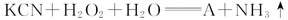
(1)生成物A的化学式为________________;
(2)在标准状况下有0.448 L氨气生成,则转移的电子数为________________;
(3)反应中被氧化的元素为________________;
(4)H2O2被称为绿色氧化剂的理由是______________________。
16.抗击“非典”期间,过氧乙酸(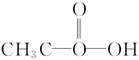 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0,涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0,涉及下列反应:
①
②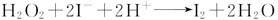
③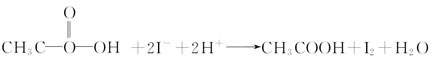
④
请回答以下问题:
(1)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是________________________________。
(2)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol/L的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol/L的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0=________________________________________________。
(3)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,这是否影响测定结果________________(填是或否)。
15.氧化二氯是具有刺激性气味的棕黄色气体,沸点3.8 ℃,熔点-116 ℃。制备时生成的Cl2O要冷却成固态以便操作和贮存。它与一般有机物接触会发生爆炸,遇水较易溶解(1∶100)生成次氯酸溶液。制备少量固态Cl2O可用干燥的Cl2与HgO反应,生成Cl2O和HgO·HgCl2。装置示意图如下。
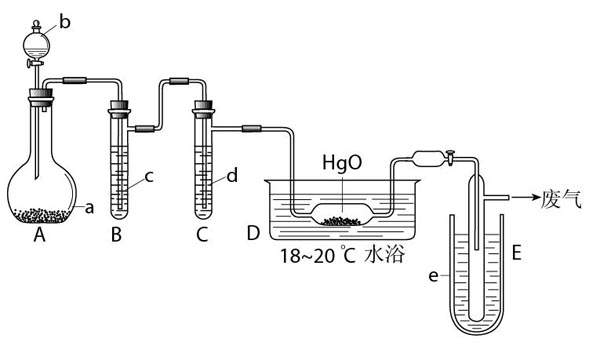 试回答:
试回答:
(1)A中盛有的深紫色固体粉末a是________________,分液漏斗中试剂b是________________;
(2)C中盛有液体是________________,作用是________________;
(3)D中发生反应的化学方程式是________________________________;
(4)保温瓶E中盛有的致冷剂是________________(提示:在干冰、冰盐水、液氮中选择)。E中得到的氧化二氯中的杂质主要是________________;
(5)D后的活塞采用高度氯化的凡士林(凡士林成分与石蜡相似)润滑和密闭,为什么不用普通的凡士林:________________________________。
14.将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通气后混合液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。
进行此实验,所用的仪器列于下表中。
|
编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
仪 器 及 导 管 |
 |
 |
 |
 (一个) |
 (一个) |
 橡皮管 |
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是___________;
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是___________________;
(3)仪器①的橡皮塞上应有个孔,原因是___________;
(4)实验时,仪器①中除观察到红光外还有___________现象;
(5)实验需用约10% H2O2溶液100 mL,现用市售30%(密度近似为1 g/cm3)H2O2来配制,其具体配制椒ㄊ?/span>________________;
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是________________。
13.据报载,一家庭主妇在家中打扫卫生时,为了获得更强的去污能力,把洁厕液(用盐酸勾兑成)与漂白粉(有效成分为次氯酸钙)混合使用,致使发生化学反应产生氯气,导致氯气中毒。试写出产生氯气的化学方程式:__________________。
12.KClO3和浓盐酸在一定温度下反应生成绿黄色的易爆物二氧化氯。其变化表述为:
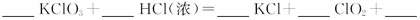
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入空格)。
(2)浓盐酸在反应中显示出来的性质是________________(填编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_____倍。
10.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )。
A.酸性B.碱性C.氧化性D.还原性
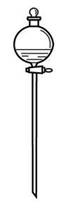
 11.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),向锥形瓶中加入下列哪些物质后,发生如右图所示变化()。
11.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),向锥形瓶中加入下列哪些物质后,发生如右图所示变化()。
①NaOH粉末 ②18 mol/L的硫酸 ③NH4NO3晶体 ④Na2O2固体 ⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
9.可用于分离MgCl2与AlCl3混合溶液的是( )。
A.氢氧化钠、盐酸 B.盐酸、氨水
C.氢氧化钠、氨水 D.氢氧化钠、二氧化碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com