
题目列表(包括答案和解析)
2.下列分离提纯方法不正确的是 ( )
A.分离KNO3和氯化钠,常用结晶与重结晶 B.提纯含有碘的食盐,常用升华法
C.去除乙醇中的水分离常用蒸馏法 D.苯和酸性高锰酸钾溶液可用分液法
1. 下列各组液体混合物中,能用分液漏斗分离的是 ( )
A. 淀粉溶液中含有食盐 B. 溴乙烷中混有水
C. 乙醇中混有乙酸 D. 甲苯中混有苯酚
2、(1)
|
两组比较实验 |
观察到的实验现象 |
结论及解释 |
|
①比较有、无浓硫酸存在条件下酯化反应进行的快慢 |
有浓硫酸存在时反应较快,无浓硫酸存在时几乎不反应 |
酯化反应是可逆反应,浓硫酸既起到催化作用又起到吸水作用,有利于向酯化的方向进行 |
|
②比较在氢离子浓度相同的稀硫酸、稀盐酸作用下,酯化反应的快慢 |
反应速率几乎相等且都较慢 |
(2)小于。酯化反应是可逆反应,反应物无法全部转化成生成物。
(3)加入足量的浓硫酸和过量的乙醇。
(4)取三支试管各加入几滴乙酸乙酯,再分别加入等体积的蒸馏水、稀硫酸、氢氧化钠溶液,在70-80℃的水浴中加热几分钟,然后闻三支试管的气味。现象是:加蒸馏水的试管气味基本不变,加稀硫酸的试管还有一点气味,加氢氧化钠溶液的试管的气味几乎完全消失。结论:酯在酸或碱存在下能发生水解,在氢氧化钠存在时水解更彻底。分析:酯的水解反应是可逆过程,当加入碱时,水解生成的羧酸被碱中和,使反应彻底进行。
本资料由《七彩教育网》 提供!
2、设计实验,探究浓硫酸在生成乙酸乙酯反应中的作用
问题提出:①有浓硫酸存在条件下酯化反应是否进行得更快。②在不同的稀酸存在条件下酯化反应的快慢如何。
(1)某同学根据上述问题进行两组比较实验,请完成下表实验报告:
|
两组比较实验 |
观察到的实验现象 |
结论 |
|
①比较 |
|
|
|
②比较 |
|
|
(2)分别为1mol的乙酸和乙醇充分反应后,制得的乙酸乙酯 1mol,原因是
(3)要想提高乙酸的转化率,可采取那些措施?
(4)拓展实验:探究乙酸乙酯水解的最佳条件 (提示:比较酸性、中性、碱性条件下的水解。)。写出实验步骤、现象、结论并做出解释。
答案:1、(1)
(2)①减少晶体在洗涤时的溶解,②减少蒸馏水中溶解氧对晶体的氧化。
(3)①蒸干时溶液中的杂质离子会被带入晶体中,②蒸干时晶体会受热分解或被氧化。
(4)防止Fe2+被氧化成Fe3+。
(5)
步骤1.取少量晶体放入试管,用酒精灯加热。在试管口有液体生成,说明晶体中含有结晶水。
步骤2.取少量晶体配成溶液,将少量试样溶液分别加入到三支试管中。
(1)向第一支试管滴人2滴KSCN溶液,溶液不显红色。再向这支试管中加人几滴新配制的氯水(或H2O2)。溶液的颜色变为红色,说明有Fe3+存在,从而说明在原溶液中有Fe2+存在。
(2)向第二支试管加入浓NaOH溶液,加热,并在试管口用湿润的红色石蕊试纸检验。红色石蕊试纸变蓝,说明有NH3生成,确定在晶体中含有NH4+。
(3)向第三支试管滴入几滴用硝酸酸化的Ba(NO3)2溶液。有白色沉淀生成,说明在溶液中有SO42-存在。
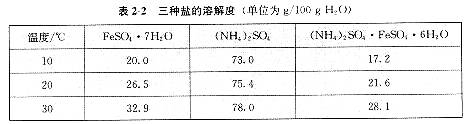
1.硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6HO,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小(见表2-2),利用这一性质可以制取硫酸亚铁铵晶体。
实验原理:
铁能与稀硫酸反应生成硫酸亚铁:Fe+H2SO4=FeSO4+H2↑硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵。
实验用品:
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。
锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸。
实验步骤
(1).Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,小火加热10 min以除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量,记为m1(Fe),备用。
(2).FeSO4的制备
将称量好的Fe屑放人锥形瓶中,加入15 mL 3mol/L H2SO4,放在水浴中加热至不再有气体生成为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体干燥后称重,记为m2(Fe)。计算反应掉的Fe的质量,进而可计算得生成FeSO4的物质的量。
(3).(NH4)2SO4·FeSO4·6HO的制备
根据FeSO4的物质的量,计算等物质的量的(NH4)2SO4的质量,称取(NH4)2SO4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体。过滤后用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
(4).称量硫酸亚铁铵的质量
称量生成的硫酸亚铁铵的质量并保存硫酸亚铁铵晶体,以备其它实验。
(1)加入(NH4)2SO4的质量为 (用含m1、m2的代数式表示)
(2)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,根据是
(3)浓缩时能否蒸发至干,为什么?
(4)制取FeSO4时,加入的Fe为什么要过量?
(5)写出对晶体中各种成分的检验的实验步骤
31.无水三氯化铁呈棕红色、易潮解,在100 ℃左右时升华。请设计一个实验,用来制取纯净、无水的FeCl3。
(要求:列出实验所需要的实验用品,写出反应的化学方程式和实验过程,画出装置图。)
30.实验室常用甲酸和浓硫酸共热制取CO,其反应的化学方程式如下:
 。回答下列问题:
。回答下列问题:
(1)该气体发生装置与下列气体的发生装置相同的是( )。
(A)NH3 (B)CO2 (C)Cl2 (D)C2H2
(2)该气体的收集方法与下列气体的收集方法相同的是( )。
(A)Cl2 (B)SO2 (C)NO (D)NO2
(3)从下列仪器中,选用最适宜组装制取、净化和收集CO装置的仪器,其中不需要的是( )。
(A)铁架台 (B)圆底烧瓶 (C)分液漏斗 (D)长颈漏斗
(E)玻璃导管 (F)洗气瓶 (G)水槽 (H)双孔胶塞
(I)酒精灯 (J)石棉网
(4)该制取反应后的尾气处理方法是__________________________。
29.在没有现成的CO2气体发生器的情况下,请你选用下图中所示的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置,应选用的仪器是(填入编号)__________________________;若用上述装置发生CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,选用药品比较合理的是选__________________________。
28.实验室制备乙烯的步骤如下:
①在一蒸馏烧瓶中加入乙醇和浓硫酸(体积比为1∶3),再加入少量碎瓷片;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170 ℃;
④气体通过稀NaOH溶液进行洗气,用排水法收集气体。
据此回答下列问题:
(1)步骤①中混合乙醇和浓硫酸时应注意的问题是__________________________;
(2)在反应液中加入碎瓷片的原因是__________________________;
(3)步骤②中温度计水银球的正确位置是__________________________;
(4)加热时,使反应液温度迅速升高到170 ℃的原因是__________________________;
(5)步骤④中,用稀NaOH溶液洗涤气体,能除去可能伴随乙烯生成的气体是__________________________;收集乙烯气体不能使用排气法的原因是____________________________________________________。
27.实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4;FeSO4与(NH4)2SO4以等物质的量混合后加热,浓缩结晶得莫尔盐。
(1)加热铁屑与稀硫酸时常常需要补充蒸馏水,原因是_____________________。
(2)实验中为减少硫酸亚铁的损失,过滤分离硫酸亚铁溶液时应注意的问题是__________________________。
(3)为防止Fe2+被氧化,实验中可采取的措施是_________________________________________________。
(4)洗涤莫尔盐用无水乙醇而不用水,原因是__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com