
题目列表(包括答案和解析)
2、将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是( )
A. HNO3 B.饱和澄清石灰水 C.C2H5OH D. H2SO4
1、2006年1月1日起,全国部分省市全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是( )
A.乙醇汽油是一种清洁能源,燃烧不会产生污染
B.乙醇与汽油组成元素相同,化学成分相似
C.乙醇汽油燃烧时,耗氧量高于等质量的汽油
D.乙醇可通过淀粉转化制得,是一种可再生的燃料
21.(A)[物质结构与性质]
 下表为长式周期表的一部分,其中的编号代表对应的元素。
下表为长式周期表的一部分,其中的编号代表对应的元素。
 请回答下列问题:
请回答下列问题:
(1)元素③的原子核外电子运动状态共有
(2)元素⑧基态原子核外电子排布式为
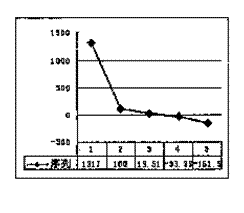
(3)②、③、④、⑤、⑥的氢化物的沸点(℃)
直角坐标图(上右图),序列“1”化合物的
电子式 ;序列“2”的氢化物,其中
心原子的杂化轨道类型是 杂化;序
列“5”的氢化物的空间构型为 。序列
“3”和“4”反应生成的产物中的化学键有
 。
。
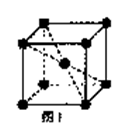
(4)元素⑦、⑧形成单质晶体哪一种空间利用率高? (填元
素符号);理由是 。图1代表的是元素⑦、⑧形
成单质晶体中的 晶体(填元素符号。)
(B)[实验化学]
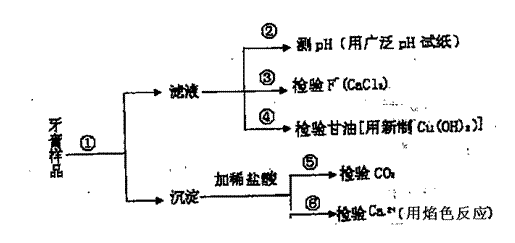 牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图。
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图。
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 ,所需要的主要玻璃仪器有 。
(2)在②中用pH试纸测溶液的pH的操作方法是 。
(3)写出④中发生反应的化学方程式: 。
(4)将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是:
、 (任答两条)。
(5)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和 溶液的反应来进行。
20.(8分)K2FeO4是一种新型、高效、多功能水处理剂,可用ClO-氧化Fe(OH)3制备。可用铬酸盐法测定K2FeO4样品中的K2FeO4的含量;向一定量的CrCl3溶液中加入KOH溶液,在加入一定量K2FeO4样品(Cr3++3OH-+FeO2-4=Fe(OH)3↓+CrO2-4),加入酸(2CrO2-4+2H+=Cr2O2-7+H2O)和指示剂,用0.1000mol·L-1硫酸亚铁铵滴定由紫红变成淡绿即为终点。
(1)K2FeO4作为高效、多功能水处理剂的原因有
(2)写出用ClO-氧化Fe(OH)3制备K2FeO4的离子方程式
(3)某次测定中K2FeO4样品质量为0.2000g,消耗0.1000mol/L硫酸亚铁铵溶液30.00mL,计算该样品中K2FeO4的含量。
19.(12分)格隆溴铵具有解痉、减少胃酸分泌作用,用于治疗胃及十二指肠溃疡,其合成路如下:

(1)写出下列反应的反应类型:① ③ 。
(2)反应②的反应类型是加成反应,反应②的另外一个反应物的结构简式是 。
(3)化合物D能发生的反应有
A.加成反应 B.消去反应 C.水解反应 D.醇的催化氧化反应
(4)写出反应④的反应方程式
(5)以苯乙烯为原料设计简单合理的路线合成化合物A。
18.(10分)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中。现以氯化钾和磷酸为原料制取磷酸二氢钾,反应方程式为:
H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),以下是在三正丁胺中制备磷酸二氢钾的工艺流程:
KH2PO4(aq)+HCl(aq),以下是在三正丁胺中制备磷酸二氢钾的工艺流程:

已知:三正丁胺是不溶于水的有机溶剂,与氯化氢反应生成一种可溶于水的盐,能使磷酸二氢钾在水中的溶解度降低。
(1)该流程中所获副产品氮肥的主要成份是 。
(2)使用三正丁胺能促进该反应进行的原因是 。除该方案外,促进该反应进行还可采取的措施有 。
(3)当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl‑质量分数低于0.2%。

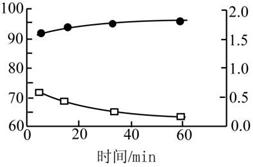
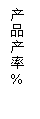

由图中可知,当反应进行到约 分钟时,KDP晶体达到一级品标准,此时的产品产率约为 。
4.0×10-4mol/L。则CO的补燃转化率为______。
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应式 。
17.(2分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式_______。
(2)25℃时,反应CO2(g) CO(g)+
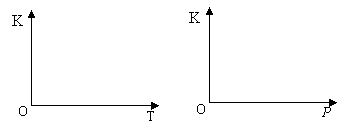
O2(g)的平衡常数K=1.72×10-46。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是① 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K与温度(T)、压强(p)变化的示意图。
CO(g)+
O2(g)的平衡常数K=1.72×10-46。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是① 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K与温度(T)、压强(p)变化的示意图。
(3)1600℃时,反应CO(g)+ O2(g) CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为
CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为
16.(8分)A-H及X均为中学化学常见物质,X是一种金属单质,A、B是两周期表中相邻元素,且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)
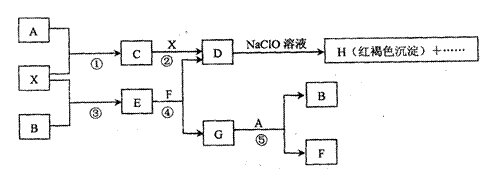
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是 (填编号);
(3)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
(4)请写出C腐蚀铜板制印刷电路板的离子方程式: ,
15.(10分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.63g。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。

试回答下列:
(1)装置A中发生反应的化学方程式为: 。
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(3)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。如何防止E中液体挥发 。
(4)F装置中干燥管内所盛物质是 作用是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com