
题目列表(包括答案和解析)
1.3 分析与综合
提问:①“H2S←S→SO2→SO3”中物质向右转化是一个什么过程?[氧化]
②连续向右转化是什么过程?[连续氧化]
③写出连续氧化的具体路径。[H2S→S→SO2→SO3;H2S→SO2→SO3;FeS→SO2→SO3;FeS2→SO2→SO3等]
④分析连续氧化的特点。[低价元素分步失去电子,化合价逐渐升高,逐步被氧化]
⑤分析连续氧化的条件。[该元素至少存在三个价态]
任务:指出连续还原有哪些具体的路径,并分析连续还原的特点和条件。(交流略)
过渡:高价元素一般具有氧化性,低价元素一般具有还原性,高价元素和低价元素往往能够发生什么反应?[归中反应]有何特点?[生成中间价物质]有什么条件?[必须存在中间价]具体有哪些反应?
交流:S+2H2SO4(浓)=△=3SO2↑+2H2O;S+2SO3==3SO2↑;2H2S+SO2=2H2O+3S。
思考:①“H2SO3→NaHSO3→Na2SO3”的转化有什么特点?[逐步失去H+,“连续碱化”]②类似的过程有哪些?
③如果逆向进行呢?[逐步得到H+,“连续酸化”]
1.2 质疑与对比
质疑:同一类的物质,化学性质是否相同?
对比:化学性质的差异表现及解释:①单质:S、O2、O3;②氢化物:H2S、H2O、H2O2。
交流:(唤起对感性表现的回忆,并进行理性或感性的分析)
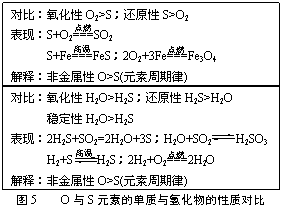

质疑:相同化合价的同种元素,其氧化性、还原性是否相同?
对比:根据物质的性质表现分析①SO2、H2SO3、Na2SO3的还原性;②H2SO4(稀)与H2SO4(浓)氧化性。
交流:(在引导学生回忆具体物质氧化还原性的基础上,让学生分析物质性质的差异性,并从构成或结构进行分析)


1.1 回顾与整理
 提问:①氧族包括哪些元素?有规律地写出元素名称和符号。[氧O、硫S、硒Se、碲Te、钋Po]
提问:①氧族包括哪些元素?有规律地写出元素名称和符号。[氧O、硫S、硒Se、碲Te、钋Po]
 ②比较五种元素,为什么列为一族?[元素周期表第ⅥA族-位置,最外层电子数为6-结构]
②比较五种元素,为什么列为一族?[元素周期表第ⅥA族-位置,最外层电子数为6-结构]
③对比五种元素,选出代表元素并说明理由。
交流:(出现两组观点)O:作为这一族的名称;最为常见;在自然界中含量最高。S:族中有三种固态非金属,硫最具代表性;硫的化合价较全面。
表决:(通过交流,学生的认识从感性走向理性)选择硫元素作为氧族元素的代表。
任务:按记忆规则写出常见含硫物质的化学式,并说明记忆的规则。
交流:(图1-3)(注:图3中NaHSO3、NaHSO4因受图1中介绍酸式盐影响而被学生补充)

总结:以物质的组成分类、转化关系及S元素的化合价等方法记忆含硫物质有各自的优点,物质的组成结构决定物质的性质,因此物质的组成分类(属于组成和结构)决定化合价(属于化学性质)及转化关系(属于化学性质),兼顾考虑物质分类、化合价及转化关系等要素,可以设计更为全面的记忆图式。
整理:(通过交流,学生的视角从局部走向整体)(图4)


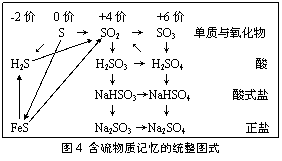
17、“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子)。若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁。”如果要求产品尽量不含杂质离子,而且成本较低。流程中所用试剂或pH值控制可参考下列附表确定。
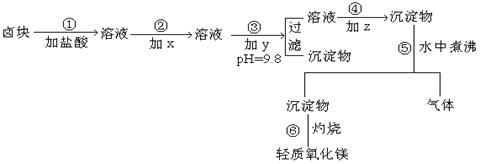
表1: 生成氢氧化物沉淀的pH值
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6* |
|
Mn(OH)2 |
8.3 |
9.8 |
|
Mg(OH)2 |
9.6 |
11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去。所以常将它氧化成为Fe3+ ,生成Fe(OH)3沉淀而去除之。
表2: 化学试剂价格表
|
试剂 |
价 格 (元/吨) |
|
漂液(含NaClO 25.2%) |
450元 |
|
H2O2(30%) |
2400元 |
|
NaOH(固 98%) |
2100元 |
|
Na2CO3
(固 99.5%) |
600元 |
|
卤块(MgCl2 , 30%) |
310元 |
请填写出以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)在步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是: 。
16、海洋植物如海带、海藻中含有丰富的碘元素.碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下图:
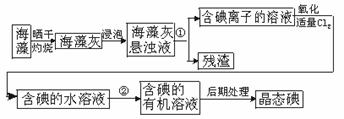
(1)指出制取碘的过程中有关的实验操作名称:
①________________________________________________________________________.
②________________________________________________________________________.
(2)提取碘的过程中.可供选择的有机试剂是_______________.
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液.实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是____________.
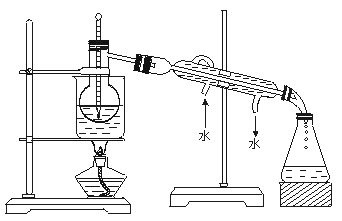
(4)从含碘的有机溶液中提取碘和回收有机溶液.还需要经过蒸馏.观察上述实验装置指出其错误之处.并加以改正。
(5)进行上述蒸馏操作时.使用水浴的原因是________________________________.最后晶态碘在______________里聚集。
15.铜在自然界多以+1价矿石存在,因为在固态特别是高温下+1价铜的化合价比+2价稳定。从辉铜矿(Cu2S)炼铜的方法之一是:将矿石高温通空气焙烧,生成两种氧化物。将焙烧过的矿石加上比它质量约少一半的未经焙烧的矿石,混合后隔绝空气再进行高温燃烧,结果得到金属铜和一种具有刺激性气味的气体。这两个反应的化学方程式为:
________________________________, __________________________。
14、在使用蒸馏烧瓶蒸发液体时,通常要放少量 ,以防止 。蒸馏烧瓶中所所盛放的液体不能超过蒸馏烧瓶容积的 ,不少于 。
13、Mg、Al两种金属分别跟同体积,同浓度的稀硫酸反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是( )
A、两个反应电子转移数目相等 B、加入Mg、Al的质量比为4:3
C、金属溶解的物质的量相等 D、加入的两种金属质量不等
12、甲、乙、丙三种溶液中各有一种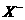 (
(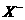 为
为
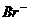 或
或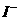 )离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
)离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
A、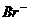
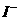
 B、
B、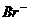

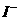 C、
C、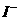

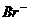 D、
D、
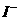
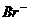
11、下列金属中,既可以用解法,又可以用电解法制取的是( )
A、Na B、Fe C、Ag D、Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com