
题目列表(包括答案和解析)
2、概念的联系
氧化剂(具有__性) -__电子-被__-发生__反应-__产物。
还原剂(具有__性) -__电子-被__-发生__反应-__产物
1.氧化还原反应的概念
(1)氧化还原反应:________的化学反应叫做氧化还原反应。
①氧化还原反应的本质是_______。②氧化还原反应的特征是_______。
(2)氧化反应和还原反应:_______ 的反应称为氧化反应;_______ 的反应称为还原反应。
(3)氧化剂和还原剂:在氧化还原反应中,______的反应物叫做氧化剂;而______的反应物叫做还原剂。
(4)氧化性和还原性:氧化性是指__剂具有的能力,表现在反应中是化合价有___趋势的一种表现能力;还原牲是指 __剂具有的能力,表现在反应中是化合价有___趋势的一种表现能力。是指得失电子的能力与多少无关。
(5)氧化产物和还原产物:_____失去电子被_____所得的产物叫氧化产物;____得到电子被____所得的产物叫还原产物。
4.溶液中离子能否大量共存
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存.
(1)有气体产生。如CO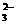 、S0
、S0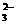 、S2-、HCO
、S2-、HCO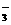 、HSO
、HSO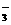 、HS-等易挥发的弱酸的酸根与H+不能大量共存。
、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Ag+等不能与SO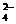 、CO
、CO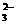 等大量共存;Mg2+、Fe2+、Ag+、Al3+、Cu2+、Fe3+等不能与OH-大量共存; Ag与I-等不能大量共存。
等大量共存;Mg2+、Fe2+、Ag+、Al3+、Cu2+、Fe3+等不能与OH-大量共存; Ag与I-等不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、C1O-、A1O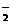 、SiO
、SiO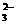 、等与H+不能大量共存;一些酸式弱酸根如HCO
、等与H+不能大量共存;一些酸式弱酸根如HCO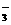 、HSO
、HSO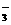 不能与OH-、H+存;NH
不能与OH-、H+存;NH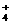 与OH-不能大量共存。
与OH-不能大量共存。
(4)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO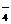 、NO
、NO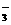 、ClO-与S2-、HS-、S0
、ClO-与S2-、HS-、S0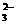 、I-、Fe2+等不能大量共存;
、I-、Fe2+等不能大量共存;
(5)溶液中能发生络合反应的离子不能大量共存。如Fe2+、Fe3+与SCN-不能大量共存;
附加隐含条件的应用规律:
(1)溶液无色透明时,则溶液中肯定没有有色离子.常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等.
(2)强碱性溶液中肯定不存在与OH-起反应的离子.
(3)强酸性溶液中肯定不存在与H+起反应的离子.
三:氧化还原反应
3. 离子方程式的正误判断:(1)看是否符合客观事实。(2)看物质化学式的拆分是否正确。(3)看是否漏掉了隐含反应。(4)看电荷和质量是否守恒。(5)看反应是否与量或滴加顺序有关。
2. 离子反应及其发生的条件
⑴.电解质在水溶液中反应的实质
① 离子反应的实质:多种电解质在水溶液中发生电离,产生能够自由移动的离子,不同离子之间发生反应生成沉淀、气体、水等使某些离子的浓度减少。
② 离子反应发生的条件 (离子不能大量共存的规律)-- 物质之间能发生复分解反应
生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-、Ca2+与OH-、Mg2+与CO32-、OH-等之间发生离子反应。
生成气体或挥发性物质:如NH4+与OH-,H+与OH-、CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等之间发生离子反应。
生成弱电解质:如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水也是种弱电解质)。
⑵.书写离子方程式的步骤
写:写出正确的化学方程式;
拆:将化学方程式中易溶解于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水的物质、气态物质和水仍用化学式表示;
删:删去方程式等号两边重复的离子;
查:检查是否满足元素原子守恒、反应前后电荷守恒等。
⑶ 与量有关的复杂的离子方程式
① NaOH溶液与少量Ca(HCO3)2溶液反应:
2OH- + Ca2+ + 2HCO3- === CaCO3↓+2H2O + CO32-
NaOH溶液加入过量Ca(HCO3)2溶液反应:
OH- + Ca2+ + HCO3- === CaCO3↓ + 2H2O
② NaHSO4 溶液中加入过量的Ba(OH)2溶液
H+ + OH- + Ba2++ SO42 === BaSO4↓+H2O
NaHSO4 溶液中加入少量的Ba(OH)2溶液
2H+ + SO42 + 2OH- + Ba2+ === BaSO4↓+ 2H2O
③ FeBr2溶液通入过量氯水
2Fe2++ 4Br- + 3Cl2 === 2 Fe3++ 2Br2 + 6Cl -
FeBr2溶液通入少量氯水
2Fe2++ Cl2 === 2Fe3++ 2Cl-
1. 酸、碱、盐在水溶液中的电离
⑴.电离、电离方程式
① 电离:酸、碱、盐等溶于水或受热熔化时,离解成能够自由移动的离子的过程。
② 电离方程式:表示电解质电离的化学方程式。
⑵.电解质与非电解质的区别
|
|
电解质 |
非电解质 |
|
定义 |
在水溶液里或熔融状态下能导电的化合物 |
在水溶液里和熔融状态下都不导电的化合物 |
|
化合物类型 |
离子化合物(强碱、盐),强极性共价化合物 |
非极性共价化合物、弱极性共价化合物、大多数有机物 |
|
能否直接电离 |
溶于水或熔融时,直接能电离 |
溶于水或熔融时,不能直接导电 |
|
实例 |
H2SO4、HF、CaO等 |
SO3、NH3、CH4等 |
⑶.强弱电解质的区别
|
|
强电解质 |
弱电解质 |
|
|
相 同 点 |
都是电解质,在水溶液中都能电离,都能导电,与溶解度无关 |
||
|
不 同 点 |
电离程度 |
完全电离 |
部分电离 |
|
电离过程 |
不可逆过程 |
可逆过程,存在电离平衡 |
|
|
表示方法 |
电离方程式用“==” |
电离方程式用“ ” ” |
|
|
水溶液中微粒存在形式 |
电离出的阴、阳离子,不存在电解质分子 |
既有电离出的阴、阳离子,又有电解质分子 |
|
|
实 例 |
绝大多数盐:NaCl、BaSO4等。 强酸:H2SO4、HCl、HClO4等。 强碱:Ba(OH)2、Ca(OH)2等。 |
弱酸:H2CO3、CH3COOH等。 弱碱:NH3·H2O、Cu(OH)2等。 极少数盐。 |
3.加热:如煮鸡蛋。
③胶体介稳定的原因:
胶体粒子具有相对较大的表面积,能吸附离子而带电荷,所以胶体粒子带电。同种胶体粒子带同种电荷,互相排斥;另外,胶体粒子在不停的做布朗运动。
一般说来,金属的氢氧化物、金属氧化物的胶体粒子带正电荷;非金属氧化物、金属硫化物、硅酸胶体的胶体粒子带负电荷。
④胶体的应用:
土壤的保肥作用、制豆腐的化学原理、江河入海口处形成三角洲、明矾净水等。
二:离子反应
2.加带相反电荷的胶粒;
2. 分散系及其分类
⑴ 定义:一种(或几种)物质以粒子形式分散到另一种物质里所形成的混合物。
 ⑵ 组成:分散质--被分散成微粒的物质
⑵ 组成:分散质--被分散成微粒的物质
分散剂--微粒分散在其中的物质
⑶ 分类:当分散剂是液体或水时,按分散质粒子的大小分类:
|
分散系 |
溶液 |
胶体 |
悬(乳)浊液 |
|
分散系粒子的直径 |
<1nm |
1nm-100nm |
>100nm |
|
分散质粒子的组成 |
小分子或离子 |
大分子或分子集合体 |
许多分子的集合体 |
|
外观 |
均一、透明 |
大多均一、透明 |
不均一、不透明 |
|
能否透过滤纸 |
能 |
能 |
一般不能 |
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
实例 |
食盐水、糖水 |
淀粉胶体、Fe(OH)3胶体 |
泥水 |
⑷ 胶体
①胶体的制备:Fe(OH)3胶体的制备:___________________________
②胶体的性质
A:丁达尔效应:光束通过胶体,形成光亮的“通路”的现象
B:布朗运动:胶体分散质粒子作不停的、无秩序的运动的现象
C:电泳现象:在外加电场的作用下胶体微粒在分散剂里做定向移动的现象,叫做电泳。
D:胶体的聚沉:消除胶粒所带电荷,并使其凝集沉降的方法
方法 1.加电解质溶液(也称盐析):如盐卤点豆腐。
1. 简单分类法及其应用
⑴ 物质分类的方法
⑵ 化学反应分类的方法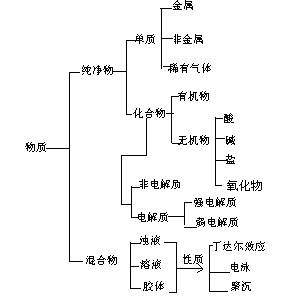
① 四种基本反应类型
|
反应类型 |
举 例 |
表 示 式 |
|
化合反应 |
C+O2
 CO2 CO2 |
A+B==AB |
|
分解反应 |
CaCO3
 CaO+CO2↑ CaO+CO2↑ |
AB==A+B |
|
置换反应 |
C+CuO  Cu+CO↑ Cu+CO↑ |
A+BC==AC+B |
|
复分解反应 |
AgNO3+NaCl==AgCl↓+NaNO3 |
AB+CD==AD+CB |
② 根据化合价是否变化 -- 氧化还原反应和非氧化还原反应
③ 据反应中是否有离子参与 -- 离子反应和分子反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com